近日,中國科學院廣州生物醫藥與健康研究院李尹雄研究員課題組在Life Science Alliance上發表了題為Hepatic DKK1 driven steatosis is CD36-dependent的研究論文。這項研究闡明了高脂飲食誘導肝內DKK1升高進而促進肝脂肪變性的病理基礎。 DKK1通過ERK-PPARγ軸上調CD36增加脂肪酸攝取,通過上調JNK信號加劇肝胰島素拮抗,兩者的疊加是DKK1驅動脂肪肝的關鍵事件。
隨著膳食結構和生活方式的改變,非酒精性脂肪肝(Non-alcoholic fatty liver disease, NAFLD)已成為全球最常見的可逆性代謝性紊亂,有25%的NAFLD進行性發展為脂性肝炎,1.8-12%發展成肝纖維化,甚至肝硬化和肝功能失代償性肝功能衰竭,后兩者占有全球肝器官移植的首位;還有2.7-3.24%的肝纖維化最終發展成肝細胞肝癌;NAFLD進行性發展的并發癥包括II型糖尿病和心腦血管病等嚴重的代謝性疾病。以NAFLD為起點的進行性疾病譜嚴重威脅人群的健康和生命,給家庭和社會帶來巨大的經濟和精神負擔。因此深入研究NAFLD進行性發展的病理機制,尋找潛在的治療靶點有著重要的現實意義。課題組通過對臨床NAFLD活檢肝組織的表達分析,發現DKK1的表達與NAFLD存在正相關性,進一步利用體內體外肝脂肪變性模型確定這一相關性。然后,通過腺相關病毒、慢病毒和CRISPR/Cas9技術構建肝特異DKK1過表達與敲除小鼠以及人、鼠肝細胞系,從正反兩方面確證了DKK1與NAFLD發生發展之間的因果關聯,抑制DKK1的表達可緩解NALFD的進程。
進一步利用生物信息學分析深度挖掘DKK1與肝細胞脂肪變性的分子網絡關聯,發現DKK1能夠顯著影響脂肪酸攝取通路和胰島素敏感性相關信號通路的變化。然后通過檢測體內體外相關基因的mRNA和蛋白表達,發現兩個DKK1潛在靶基因CD36和JNK的表達與DKK1的表達存在正相關,即敲除DKK1導致CD36和JNK的下調,過表達DKK1導致兩者的上調。進一步的機理分析揭示,DKK1調控CD36的轉錄依賴于ERK和PPARγ的信號傳導,從而證明了DKK1通過ERK-PPARγ軸上調CD36的表達,以加劇肝細胞脂質堆積。另一方面,DKK1通過上調非經典Wnt通路下游的JNK信號通路加劇肝胰島素抵抗,從而加劇肝脂肪變性。在NAFLD病理機制研究中,該發現具有一定的原創性,并且為預防和治療非酒精性脂肪肝病的藥物研發提供了新的潛在靶點。
廣州健康院博士研究生楊振為該研究論文的第一作者,李尹雄研究員為通訊作者。本項研究的合作單位為暨南大學第一附屬醫院。該研究獲得了國家重點研發計劃基金、國家自然科學基金、廣東省基礎與應用基礎研究基金等的支持。
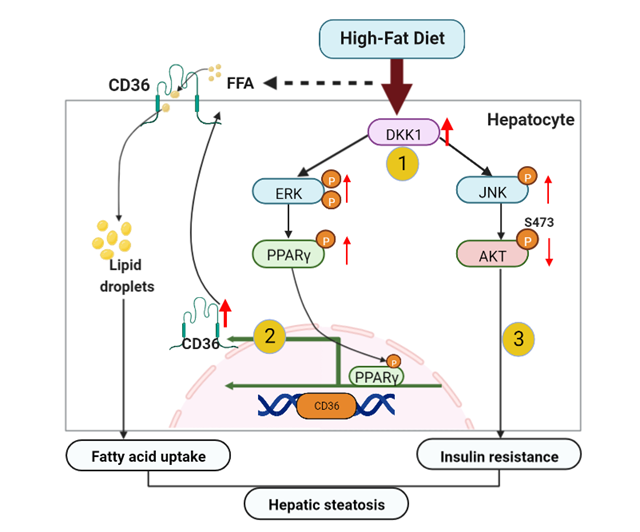
肝細胞DKK1調節肝臟脂肪變性示意圖
附件下載:


