近日,中國科學(xué)院深圳先進(jìn)技術(shù)研究院合成生物學(xué)研究所李漢杰課題組在國際學(xué)術(shù)期刊cancers上發(fā)表了題為《Pan-Cancer Analysis Identifies Tumor Cell Surface Targets for CAR-T Cell Therapies and Antibody Drug Conjugates》的研究成果。
該研究針對臨床嵌合抗原受體治療(CAR Therapy)過程中容易出現(xiàn)的脫靶(off target)效應(yīng),瘤外毒性(off-tumor toxicity)等副作用[1],在設(shè)計課題思路時巧妙地排除了潛在的干擾。并構(gòu)建雙抗原對(Antigen pairs),通過分析抗原對的表達(dá)水平,對腫瘤預(yù)后的影響;并在蛋白水平上進(jìn)行了驗證,證實了目標(biāo)膜蛋白具有良好的成靶效應(yīng),這也為未來研究人員開發(fā)雙特異性抗體(Bispecific Antibody),抗體偶聯(lián)藥物(Antibody Drug Conjugates,ADC),多種嵌合抗原受體療法(包括CAR-T,CAR-NK)等治療手段提供了目標(biāo)受體。

文章上線截圖
事實上,目前細(xì)胞治療的手段只在少部分血液腫瘤中有較好的療效,主要是由于實體瘤結(jié)構(gòu)致密,血液中回輸?shù)那逗峡乖荏w的免疫細(xì)胞(主要有CAR-T, CAR-NK等)很難與腫瘤細(xì)胞充分接觸,從而達(dá)到殺傷腫瘤細(xì)胞的效果。另一方面,由于現(xiàn)行的治療手段大多是單一靶標(biāo),因此在治療時往往會出現(xiàn)殺傷效率低,易脫靶的現(xiàn)象。另外,大量研究和臨床治療選擇的靶點雖然在腫瘤細(xì)胞中表達(dá)較高,但其在某些免疫細(xì)胞中的表達(dá)也很高,這就會造成治療過程中,攻擊患者的免疫系統(tǒng),造成更嚴(yán)重的后果[2, 3]。基于以上現(xiàn)狀,研究團(tuán)隊試圖通過公共數(shù)據(jù)的分析和一系列條件篩選,獲取一批能夠克服以上缺點的候選靶點。
該成果中,研究人員首先獲取了TCGA的33種癌癥的數(shù)據(jù)信息,通過篩選留下了部分癌種,進(jìn)一步從數(shù)據(jù)庫中鎖定了定位于胞膜上的蛋白質(zhì),通過剔除潛在的免疫細(xì)胞的marker,初步獲得了用于進(jìn)一步研究的候選基因。接下來,通過進(jìn)一步表達(dá)分析,功能分析,預(yù)后影響,構(gòu)建基因?qū)ΣⅡ炞C,最終得到了371個符合預(yù)期的膜蛋白。理論上,研究中的每種癌癥的候選膜蛋白的兩兩組合用于治療可以達(dá)到更好的效果和更低的毒副作用。為了進(jìn)一步佐證結(jié)果,研究團(tuán)隊在蛋白質(zhì)層面進(jìn)行了表達(dá)水平的驗證,也展示了不同腫瘤患者可選擇的個性化治療組合。
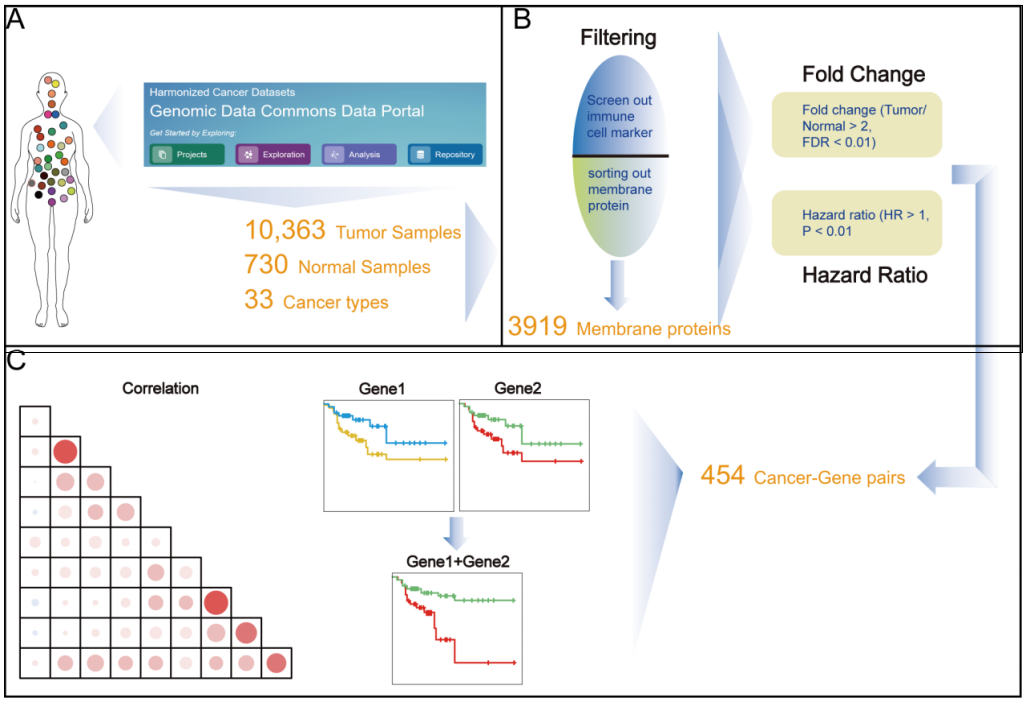
圖 | 核心工作流程說明
綜上,研究團(tuán)隊揭示了一些潛在的腫瘤特異性表面蛋白,可用于合理設(shè)計基于TSA(Tumor Surface Antigen)的免疫療法。這些發(fā)現(xiàn)可能為在前臨床動物研究和臨床實踐中利用腫瘤特異性表面蛋白作為多靶點結(jié)合位點構(gòu)建新型CAR-T細(xì)胞和ADC鋪平了道路。
中科院深圳先進(jìn)技術(shù)研究院合成所李漢杰研究員為本文主要通訊作者,中山大學(xué)生命科學(xué)學(xué)院博士研究生李心慧、南方科技大學(xué)醫(yī)學(xué)院博士研究生周建及深圳大學(xué)總醫(yī)院婦產(chǎn)科醫(yī)生張衛(wèi)文為文章并列第一作者。東南大學(xué)化學(xué)化工學(xué)院尤文化博士,深圳先進(jìn)技術(shù)研究院合成所王俊博士,青島濱海學(xué)院醫(yī)學(xué)院周林林同學(xué),深圳市第三人民醫(yī)院劉磊教授等對論文的理論和思路設(shè)計做出了重要貢獻(xiàn)。
該研究得到國家科技部重點研發(fā)計劃、國家自然科學(xué)基金委以及深圳合成生物學(xué)創(chuàng)新研究院等多個項目的支持。
參考文獻(xiàn):
[1] Autio, K. A.;Boni, V.;Humphrey, R. W., et al. Probody Therapeutics: An Emerging Class of Therapies Designed to Enhance On-Target Effects with Reduced Off-Tumor Toxicity for Use in Immuno-Oncology. Clinical cancer research : an official journal of the American Association for Cancer Research 2020, 26. https://10.1158/1078-0432.Ccr-19-1457
[2] Theruvath, J.;Sotillo, E.;Mount, C. W., et al. Locoregionally administered B7-H3-targeted CAR T cells for treatment of atypical teratoid/rhabdoid tumors. Nature medicine 2020, 26. https://10.1038/s41591-020-0821-8
[3] Zhang, G.;Dong, Q.;Xu, Y., et al. B7-H3: another molecule marker for Mo-DCs? Cellular & molecular immunology 2005, 2.
附件下載:


