5月8日,中國科學(xué)院深圳先進技術(shù)研究院合成生物學(xué)研究所嚴飛研究員的最新成果以“Cell-cycle dependent nuclear gene delivery enhances the effects of E-cadherin against tumor invasion and metastasis”為題發(fā)表于國際知名期刊Signal Transduction and Targeted Therapy。在該項工作中,研究團隊開發(fā)了一種新的在體時空可控核內(nèi)基因遞送的方法,該方法利用生物納泡(Gas vesicles, GVs)作為空化核用于攜載質(zhì)粒DNA,在細胞內(nèi)吞后借助超聲誘發(fā)載基因生物納泡在胞內(nèi)產(chǎn)生空化效應(yīng),可將質(zhì)粒DNA直接遞送至細胞核實現(xiàn)基因的轉(zhuǎn)錄和表達,鑒于超聲具有靶向聚焦的特性以及生物納泡天然的生物相容性能在細胞內(nèi)長時間保持,由此可實現(xiàn)基因時空可控地核內(nèi)基因遞送。通過以抑制腫瘤轉(zhuǎn)移功能的E-cadherin基因作為例子,研究團隊利用開發(fā)的胞內(nèi)空化核內(nèi)基因遞送方法證明了可實現(xiàn)不同時間維度上控制基因的遞送與表達,并能發(fā)揮抑制腫瘤侵襲和轉(zhuǎn)移的作用。利用該方法團隊比較了在不同細胞周期遞送E-cadherin基因,發(fā)現(xiàn)在腫瘤細胞的G2/M期控制外源基因E-cadherin的核內(nèi)遞送與表達比在G1期和S期能更有效地抑制腫瘤侵襲和轉(zhuǎn)移,進一步的分子機制研究發(fā)現(xiàn)Fam50a/Runx2-MMP13信號軸在這效應(yīng)增強過程中發(fā)揮了重要的作用。
該工作不僅可以有效提高外源基因的轉(zhuǎn)染效率,還有望開發(fā)成一種在體時空可控控制外源基因表達的工具,具有重要的應(yīng)用前景。
中科院深圳先進院合成所嚴飛研究員與浙江大學(xué)附屬第一醫(yī)院蔣天安主任為論文的共同通訊作者。來自浙江大學(xué)的深圳先進院客座學(xué)生謝麗婷為論文第一作者。

圖1 文章上線截圖
近年來,基因治療被認為是除手術(shù)、放化療之外具有巨大應(yīng)用潛力的新型治療方法,超聲靶向微泡爆破技術(shù)是一種新型的基因和藥物遞送技術(shù),其原理是利用超聲造影劑微泡作為基因的載體,借助超聲局部輻照載基因微泡,誘發(fā)微泡產(chǎn)生周期性的收縮、膨脹乃至坍塌爆破,進而產(chǎn)生微流、微射流和沖擊波等一系列空化效應(yīng),這些效應(yīng)疊加作用于臨近的細胞膜,使之產(chǎn)生瞬間可修復(fù)的微小孔隙(聲致穿孔效應(yīng)),溶液中或微泡爆破釋放的質(zhì)粒DNA趁機進入細胞,從而實現(xiàn)基因的定點遞送,該方法具有靶向、定點、可視化基因遞送等優(yōu)勢,是實現(xiàn)基因靶向遞送頗具前景的方法之一。然而,傳統(tǒng)基于微泡超聲造影劑的超聲基因遞送策略僅僅能對細胞膜進行空化穿孔實現(xiàn)外源基因由胞外向胞內(nèi)遞送,而無法將質(zhì)粒DNA直接遞送入細胞核內(nèi),導(dǎo)致超聲靶向基因轉(zhuǎn)染的效率普遍較低。針對這一問題,嚴飛研究員團隊提出了基于生物納泡的胞內(nèi)空化核內(nèi)基因遞送新方法,利用生物納泡粒徑小的特點,通過PEI表面修飾攜載質(zhì)粒DNA后將其與細胞孵育進入到細胞質(zhì),再借助超聲輻照使其在細胞內(nèi)產(chǎn)生空化效應(yīng),瞬時穿孔核膜直接將基因遞送入核內(nèi),有效提高了基因的轉(zhuǎn)染效率(流式檢測可達47%)。此外,利用生物納泡天然的相容性,且能在細胞內(nèi)穩(wěn)定存在,由此可在不同時間點施加超聲控制基因的核內(nèi)遞送與表達,成功實現(xiàn)了外源基因在體時空可控的基因表達。
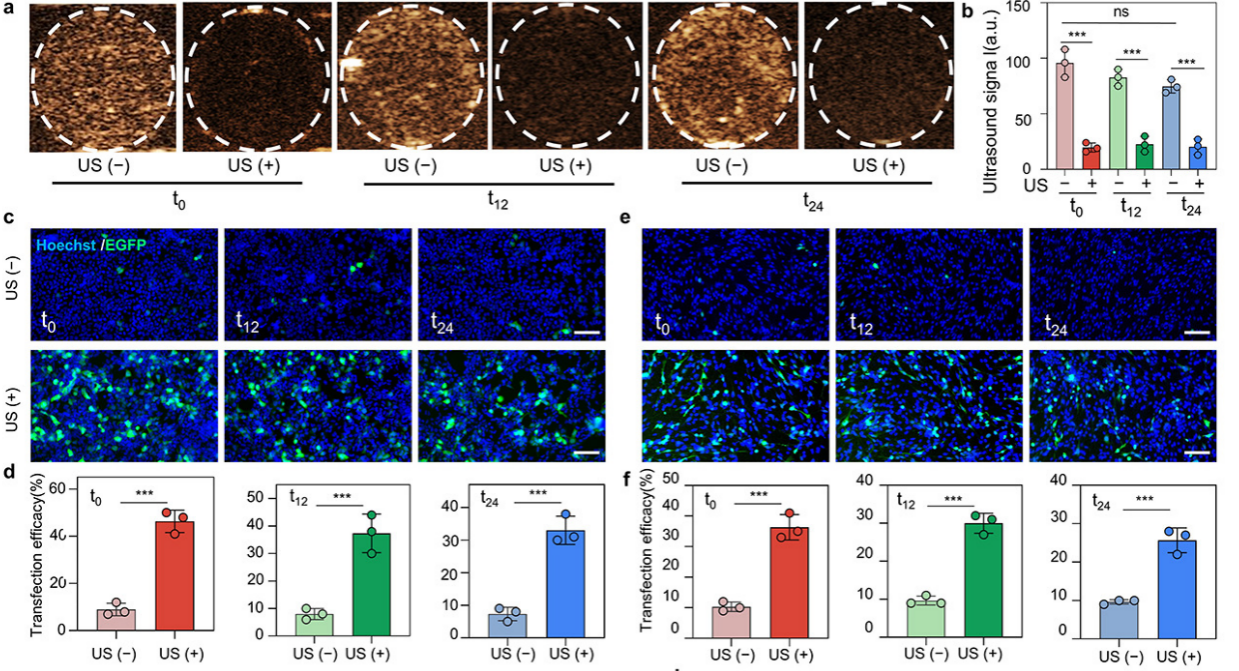
圖2 超聲可視化胞內(nèi)空化遞送EGFP基因在時間維度上控制外源基因的表達
研究團隊利用該系統(tǒng)遞送具有抑制腫瘤轉(zhuǎn)移功能的E-cadherin基因,發(fā)現(xiàn)在C6腦膠質(zhì)瘤細胞內(nèi)吞載E-cadherin的納泡后,移植到老鼠大腦分別等待0 h (t0),12 h (t12)或24 h (t24)進行超聲輻照誘導(dǎo)生物納泡胞內(nèi)空化進行基因的核內(nèi)遞送,均能有效抑制腫瘤細胞的遷移,并能延長荷瘤鼠的生存期。為了探索超聲胞內(nèi)空化核內(nèi)基因遞送在細胞周期內(nèi)的應(yīng)用,研究團隊建立了兩種不同的細胞周期運行模式,分別將腫瘤細胞同步化停留在不同細胞周期后進行超聲基因轉(zhuǎn)染和同步化細胞撤掉細胞周期阻滯劑進入到不同細胞周期后接受超聲基因轉(zhuǎn)染(腫瘤細胞先行內(nèi)吞載基因納泡)。實驗結(jié)果證實開發(fā)的核內(nèi)基因遞送方法在兩種細胞周期運行模式中的G1期、S期和G2/M期均具有相似的基因轉(zhuǎn)染效率,但在抑制腫瘤細胞侵襲和轉(zhuǎn)移的功能上卻有所不同,表現(xiàn)為在G2/M期行超聲核內(nèi)基因遞送比G1期和S期具有更好的抗腫瘤侵襲和轉(zhuǎn)移的效果。
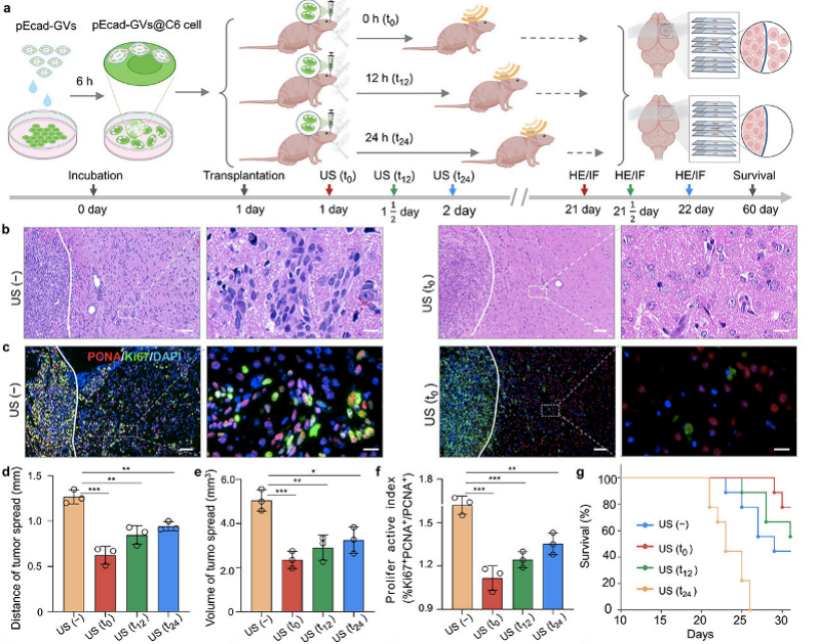
圖3 超聲胞內(nèi)空化在不同時間遞送E-cadherin有效抑制腦膠質(zhì)瘤細胞的遷移
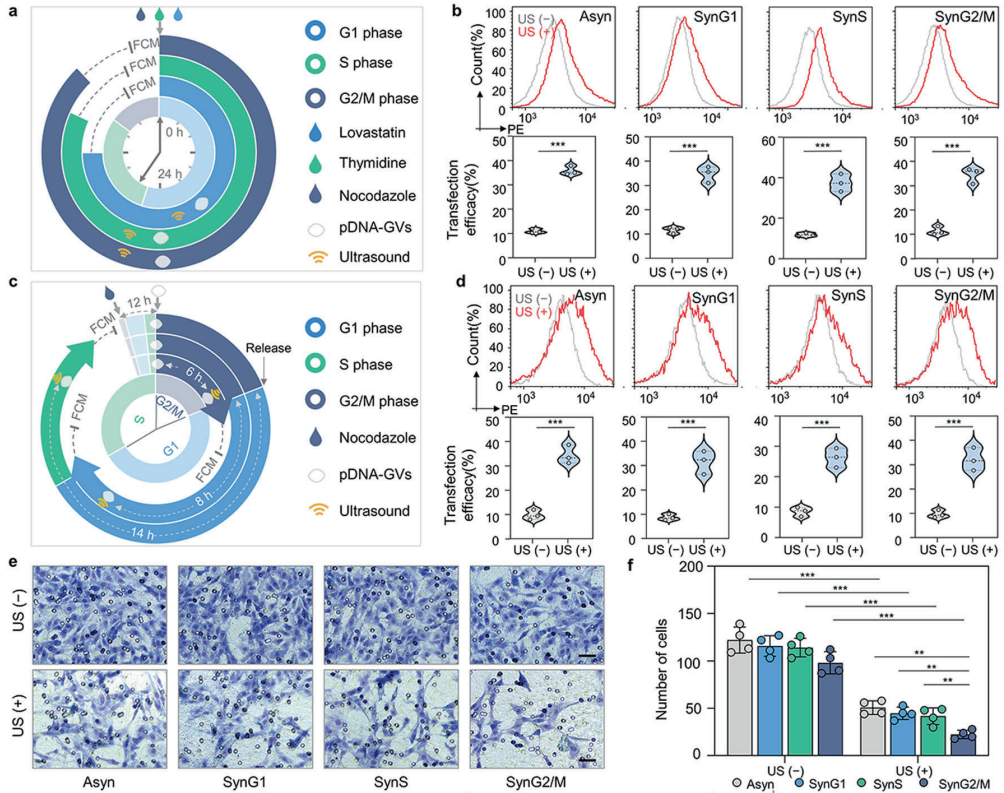
圖4 超聲胞內(nèi)空化在不同細胞周期遞送EGFP的轉(zhuǎn)染效率以及遞送E-cadherin的腫瘤遷移抑制效果
為了進一步挖掘超聲胞內(nèi)空化遞送E-cadherin在G2/M期具有更好抑制腫瘤轉(zhuǎn)移的機制,研究團隊通過轉(zhuǎn)錄組測序、qPCR、WB和CO-IP等分子實驗,發(fā)現(xiàn)在腫瘤細胞G2/M期過表達E-cadherin會導(dǎo)致Fam50a基因的下調(diào),進而減少Fam50a/Runx2的相互作用及其轉(zhuǎn)錄激活功能,最終導(dǎo)致MMP13的下調(diào),揭示了超聲胞內(nèi)空化核內(nèi)遞送E-cadherin基因在細胞周期G2/M期發(fā)揮更好抑制腫瘤轉(zhuǎn)移的機制。
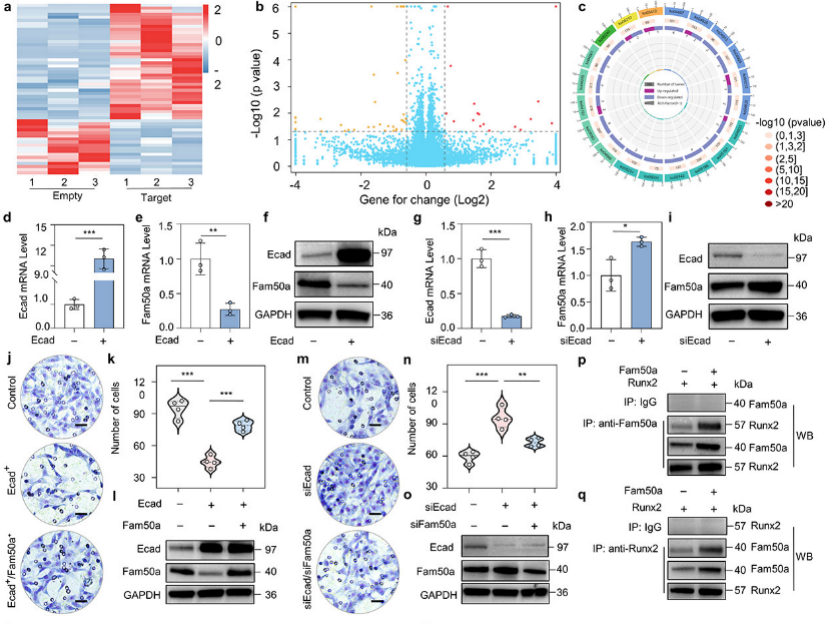
圖5 E-cadherin在G2/M期的過表達更有效地抑制了Fam50a/Runx2-MMP13信號傳導(dǎo)
該工作獲得了國家科技部重點研發(fā)計劃項目、國家自然科學(xué)基金面上項目、中科院先導(dǎo)B項目以及深圳市科創(chuàng)委和深圳合成生物學(xué)創(chuàng)新研究院等項目的支持。
Liting Xie, Jieqiong Wang, Liming Song, Tianan Jiang and Fei Yan. Cell-cycle dependent nuclear gene delivery enhances the effects of E-cadherin against tumor invasion and metastasis. Signal Transduction and Targeted Therapy, 2023; 8(1):182. doi: 10.1038/s41392-023-01398-4.
附件下載:


