人類食用鹽有很悠久的歷史,從食鹽中攝取的鈉離子和氯離子在體內扮演著重要的角色;其中氯離子作為細胞內外最大量的陰離子,發揮著多種重要的生理功能,如維持細胞內外的電中性等。氯離子的跨膜轉運由多種氯離子轉運蛋白家族介導,包括氯離子通道(chloride channel,ClC)、配體門控γ-氨基丁酸和甘氨酸受體、囊性纖維化跨膜電導調節體、陽離子- Clˉ轉運體、Clˉ/HCO3ˉ交換體、LRRC8蛋白相關的體積調節陰離子通道等。這些家族成員的氯離子轉運蛋白功能一旦發生異常便會導致相應的疾病,如ClC-1功能異常會導致肌強直、ClC-2功能異常會導致腦白質營養不良癥和醛固酮增多癥、ClC-7功能異常會導致骨骼石化癥等。由于氯離子轉運蛋白家族間有著極強的結構或功能類似性,只針對一個氯離子轉運蛋白作為藥物靶點來設計特異性藥物的難度不言而喻。
那么,在利用特異性藥物治療由相應轉運蛋白功能異常引發的疾病時,如何才能消除或盡可能減少特異性藥物脫靶所帶來的副作用?
2020年,美國斯坦福大學Anna Koster等研究者通過檢測甲氯滅酸的一系列衍生物與ClC-2的結合強度,最終得到與ClC-2特異性結合的衍生物AK-42;其結合ClC-2的強度(IC50 = 17 ± 1 nM)是ClC-1(與ClC-2結構最為相似)1000倍以上。為進一步探究AK-42是如何特異性結合ClC-2并抑制其氯離子轉運功能,研究團隊通過冷凍電鏡確定了apo態的ClC-2和ClC-2/AK-42復合物的高分辨率原子結構,基于結構通過分子動力學模擬確定參與復合物結合界面的關鍵氨基酸殘基,利用點突變和膜片鉗技術進一步驗證關鍵氨基酸殘基,最終提出特異性抑制劑AK-42堵塞ClC-2機制(如圖)。該研究為后續特異性藥物設計提供新思路。
深圳先進院助理研究員馬濤、南方科技大學博士生王雷、深圳先進院助理研究員柴安平為論文的并列第一作者;深理工藥學院講席教授Horst Vogel、深理工生命健康學院講席教授王玉田、南方科技大學教授王大平、南方科技大學助理教授閆凱歌、深圳先進院副研究員張華威為論文共同通訊作者。
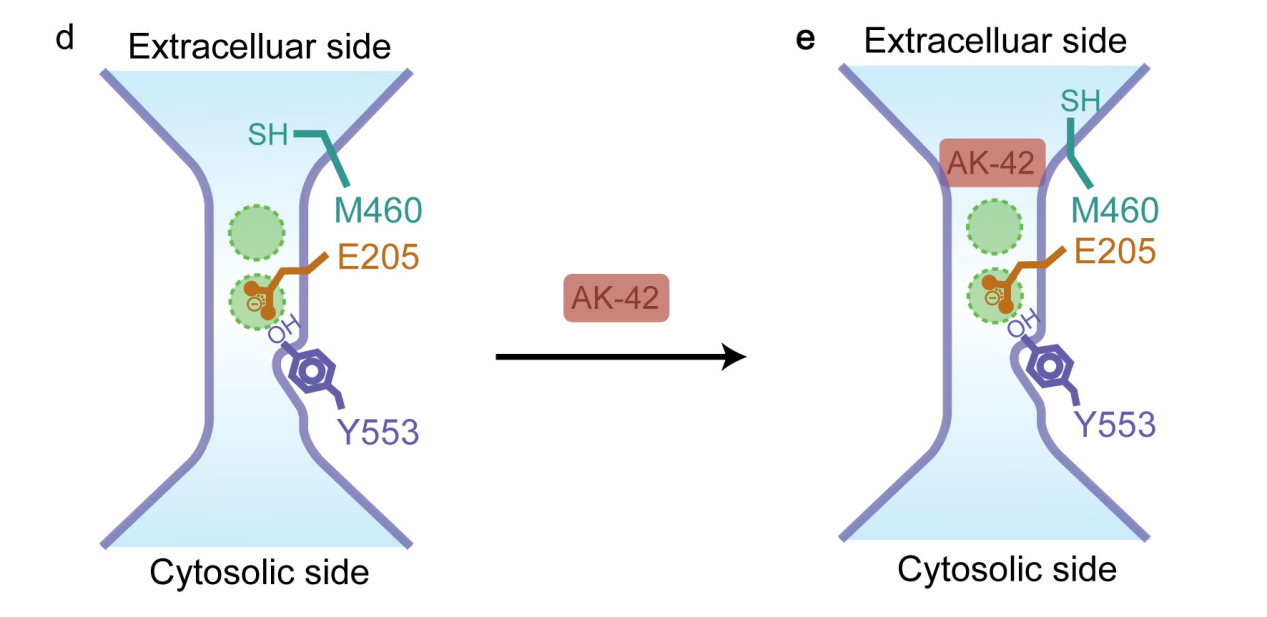
AK-42直接堵塞氯離子通道ClC-2的模型
附件下載:


