靶向蛋白降解未配對的括號或引號!Targeted Protein Degradation,TPD)作為一種新的藥物研發策略,巧妙地利用了細胞自身的降解機制,實現對特定蛋白質的選擇性清除。這一技術在解決傳統藥物難以觸及的“不可成藥靶點”問題上,展現了巨大潛力和前景。
位于細胞表面的細胞膜蛋白,廣泛參與細胞識別、物質運輸、信號轉導等生命活動,是重要的藥物研發靶點。近年來,針對細胞膜蛋白,涌現出了以LYTAC和AbTAC為代表的一系列靶向降解技術。這些技術的基本原理是構建雙功能分子,實現靶蛋白與細胞膜表面溶酶體穿梭受體或E3連接酶之間的物理綁定,并借助這些受體或酶的生物學活性,促進靶蛋白內吞至溶酶體降解。然而,它們的降解效率和適用范圍受限于這些第三方溶酶體穿梭受體或E3連接酶的活性和表達,而且強行“綁架”這些功能受體有可能導致潛在副作用。因此,開發一種不依賴第三方受體的細胞膜蛋白靶向降解技術至關重要。

文章上線截圖
1月9日,由中國科學院深圳先進技術研究院(簡稱“深圳先進院”)醫藥所納米醫療技術研究中心李紅昌研究員、房麗晶研究員、蔡林濤研究員和邵喜明副研究員組成的學科交叉團隊,在國際知名期刊Nature Chemical Biology上以“Chemically Engineered Antibodies for Autophagy-based Receptor Degradation”為題發表最新研究成果。在這項研究中,他們成功開發出一種全新的基于自噬機制的細胞膜蛋白靶向降解技術——AUTAB(autophagy-inducing antibody)。該技術通過將細胞自噬誘導分子與細胞膜蛋白靶點抗體進行共價偶聯,實現了在不依賴額外細胞表面蛋白的情況下,精確觸發靶點蛋白通過自噬-溶酶體路徑降解。這一成果為以細胞膜蛋白為靶點的藥物研發提供了一種新的廣譜適用策略。
這項創新技術的靈感來源于,自然界中病原體感染和細胞膜損傷后細胞自主啟動自噬進行清除的現象。研究團隊在篩選自噬誘導分子過程中發現,有一種廣泛應用于基因及藥物遞送的材料——聚乙烯亞胺(Polyethyleneimine,PEI),能夠高效誘導類似的細胞自噬。基于此發現,團隊利用點擊化學方法將PEI與能夠特異性識別目標膜蛋白的抗體共價連接,成功構建出一種既能精準定位又能有效激活自噬機制的AUTAB分子,從而實現了對細胞膜蛋白的靶向降解。
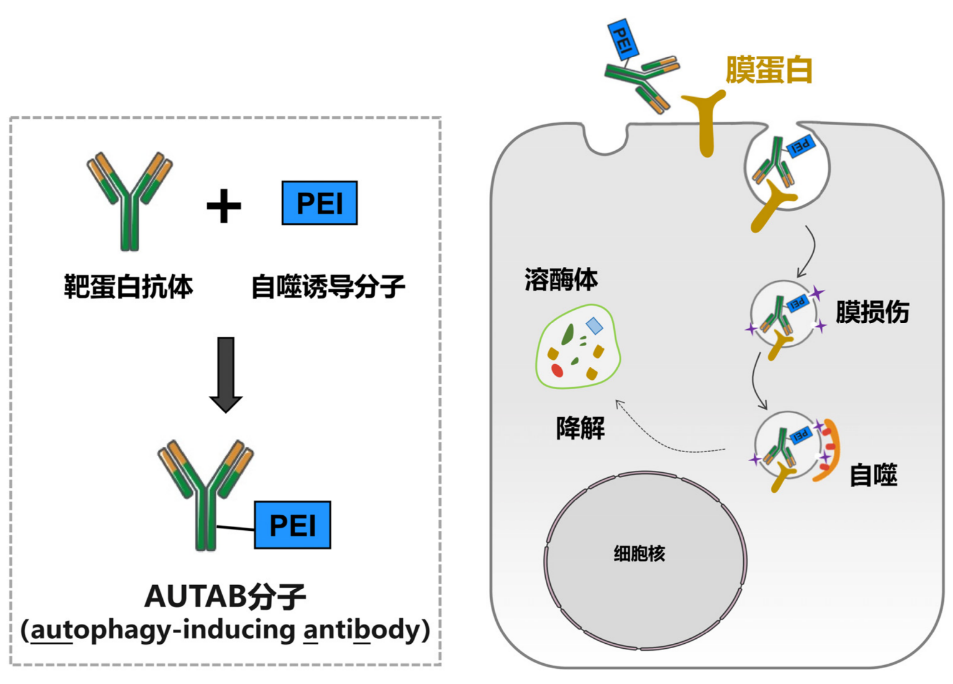
圖1. AUTAB分子的構建原理和作用模式圖。
以腫瘤免疫治療靶點PD-L1為例,團隊首先構建了一種AUTAB分子進行原理驗證。深入研究表明,AUTAB通過抗體元件與靶點蛋白特異結合后,利用PEI元件造成靶點區域膜結構微損傷,從而激活LC3C介導的自噬途徑,將靶點遞送至溶酶體降解。進一步的生化結果也顯示,無論是通過溶酶體抑制劑抑制溶酶體功能,還是敲除自噬關鍵蛋白阻斷自噬發生,均能顯著干擾AUTAB的靶向降解活性,證實了AUTAB確實通過自噬-溶酶體路徑實現靶點降解。
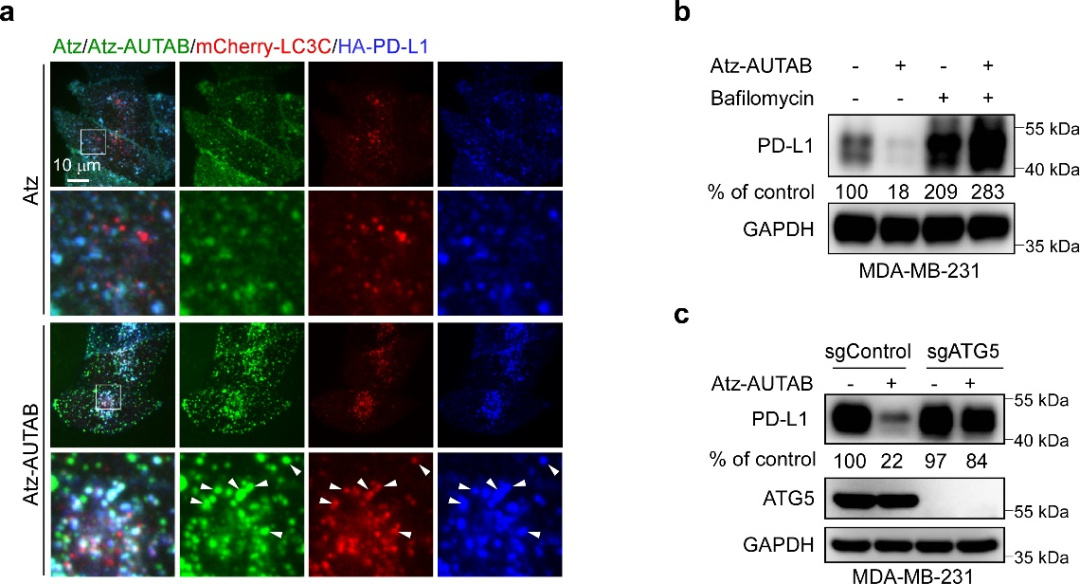
圖2. AUTAB技術的靶向蛋白自噬降解機制。(a) AUTAB誘導LC3C介導的自噬。(b) 溶酶體抑制劑Bafilomycin抑制AUTAB誘導的靶蛋白降解。(c) 敲除自噬關鍵蛋白ATG5抑制AUTAB誘導的靶蛋白降解。
在降解效率方面,由于細胞自噬本身就是一種將物質高效定向遞送溶酶體機制,因此AUTAB分子僅需極低濃度(納摩爾)即可實現對靶蛋白的降解。更重要的是,團隊驗證了AUTAB技術的廣譜適用性:不僅在多種細胞類型中都可降解靶蛋白,而且針對包括膜錨定蛋白CD73在內的各種膜蛋白均能實現高效靶向降解。
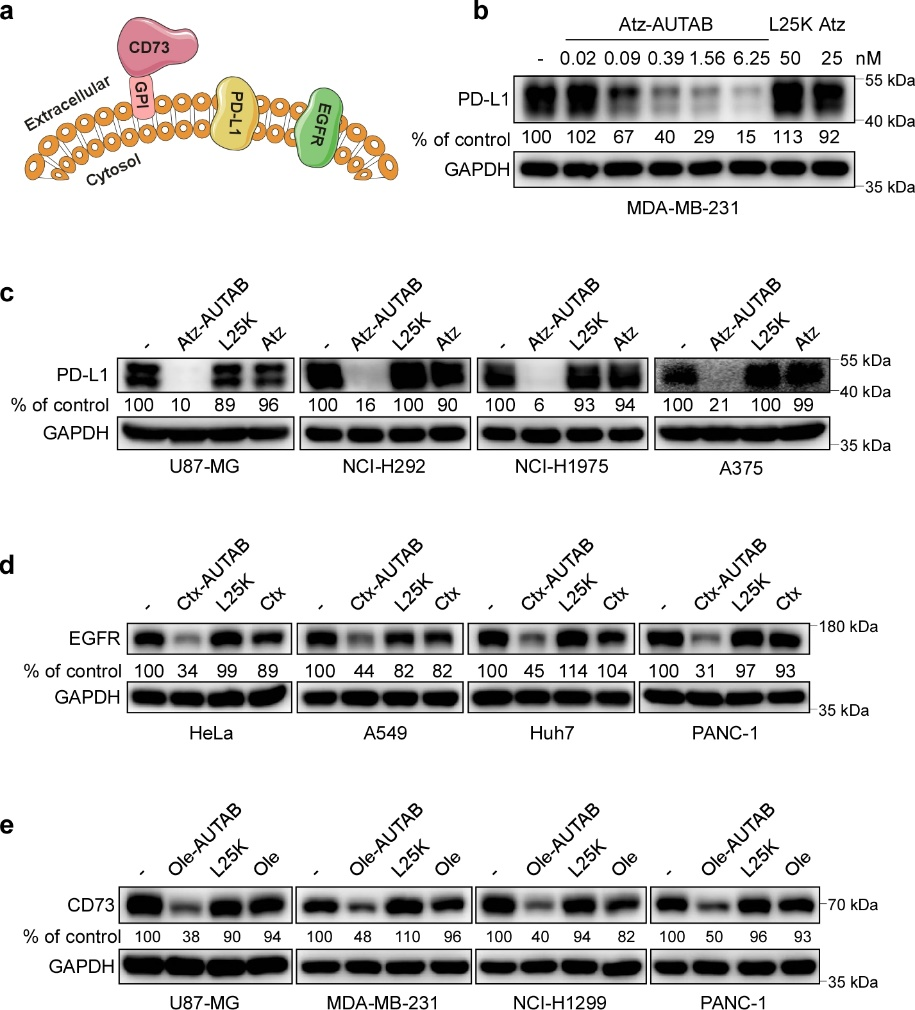
圖3. AUTAB技術的廣譜適用性。(a) 不同類型細胞膜蛋白的模式圖。(b) AUTAB誘導PD-L1降解的濃度效應。(c-e) AUTAB在不同腫瘤細胞上誘導PD-L1,EGFR以及CD73降解效果的驗證。
從化學機制角度,研究團隊揭示了AUTAB分子中PEI攜帶的正電荷是誘導細胞膜蛋白降解的關鍵機制。利用化學修飾方法部分屏蔽PEI正電荷后,AUTAB分子降解細胞膜蛋白的效率明顯下降,而使用同樣帶正電荷的多聚賴氨酸可以完美替代PEI用于構建AUTAB分子,這一結果從相反角度驗證了AUTAB降解細胞膜蛋白的正電荷機制。
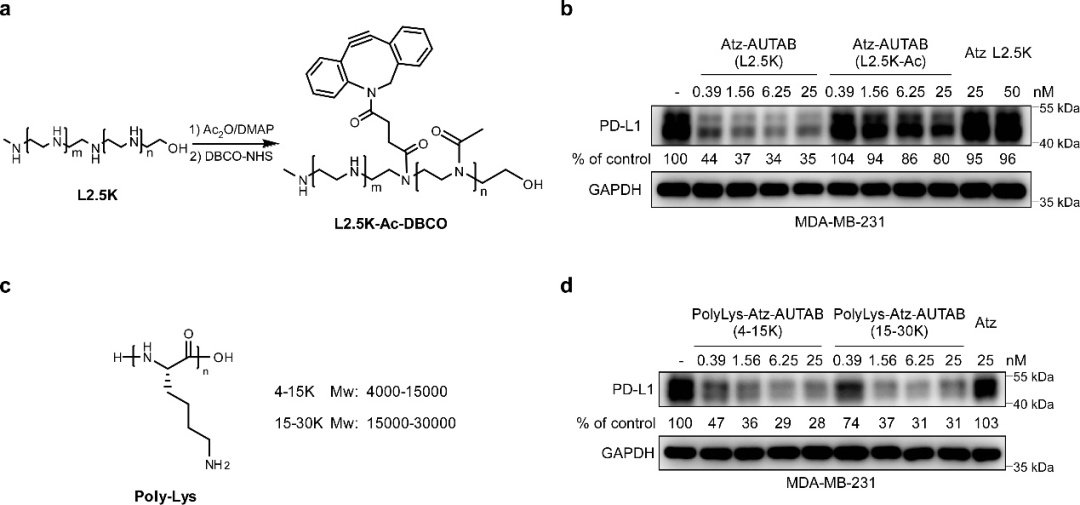
圖4. AUTAB技術的化學機制。?(a) 乙酰化封閉PEI正電荷。(b) 低電荷AUTAB誘導膜蛋白降解活性驗證。(c) 攜帶正電荷的多聚賴氨酸化學結構。(d) 多聚賴氨酸構建的AUTAB分子誘導膜蛋白降解活性驗證。
為提升AUTAB技術的使用可及性和便利性,研究團隊進一步開發了一種模塊化的Nano-AUTAB系統。不同于將PEI直接與靶點抗體偶聯形成AUTAB的技術路徑,Nano-AUTAB系統中的PEI被共價連接在一個能夠識別抗體IgG的納米二抗上,在使用時通過搭配不同的細胞膜蛋白抗體即可實現對各種細胞膜蛋白的靶向降解,由此獲得了一種通用AUTAB分子,展現出更加廣泛的應用潛力。
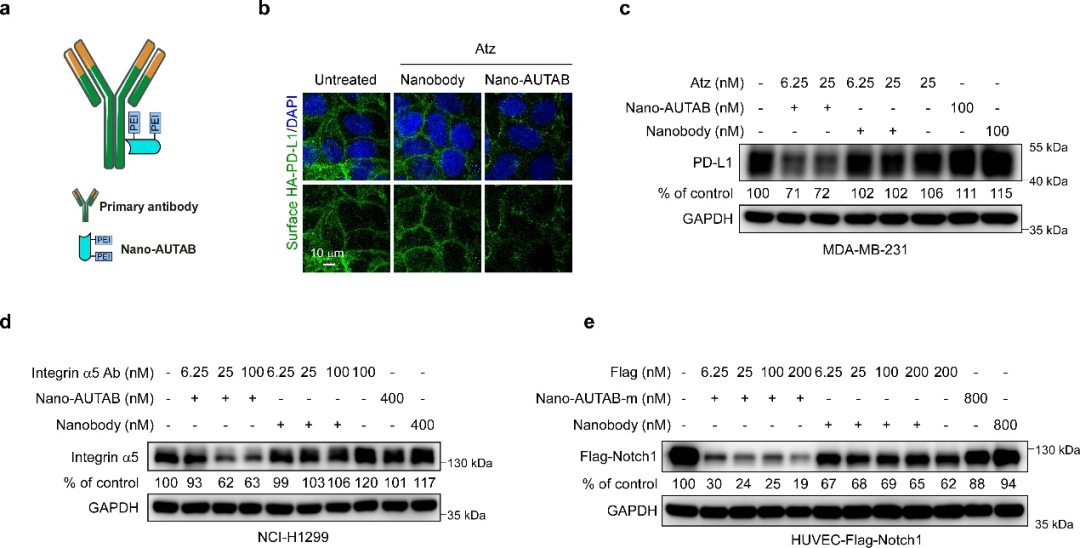
圖5. 模塊化的Nano-AUTAB。?(a) Nano-AUTAB模式圖。(b-c) Nano-AUTAB誘導PD-L1降解活性驗證。(d) Nano-AUTAB誘導Integrin α5降解活性驗證。(e) Nano-AUTAB誘導標簽模式膜蛋白降解活性驗證。
綜上所述,該研究創新性地基于細胞自噬原理開發了一種細胞膜蛋白降解平臺。該技術不僅降解效率高,而且具有廣譜適用性和簡單便捷性,未來無論在科學研究領域還是藥物研發方向,都具有重要應用潛力。
深圳先進院博士生程冰華、副研究員李梅青、研究助理鄭紀維是該論文的共同第一作者;李紅昌研究員、房麗晶研究員、蔡林濤研究員、邵喜明副研究員為論文共同通訊作者。該研究得到了國家重點研發計劃,國家自然科學基金,廣東省自然科學基金和深圳市科技計劃的資助。
團隊專注于應用交叉學科技術,研發腫瘤等疾病的創新治療策略,相關成果發表在Nature Chemical Biology,Nature Nanotechnology等期刊。團隊長期招收化學生物學,納米生物學和細胞生物學等相關專業的碩士/博士研究生和博士后,歡迎有志之士加入。
附件下載:


