上皮細胞層是人體抵御外界感染的第一道防線,在維持身體正常狀態、保護屏障和抵抗感染的過程中,其形狀和結構會不斷發生變化。研究發現,細菌能夠通過識別器官組織的幾何特性以破壞細胞層的保護作用并引發感染擴散。雖然理解清楚組織器官幾何特性調控細菌感染的具體機制對開發新型抗感染療法具有關鍵意義,但這一科學問題尚未得到充分揭示。
4月21日,中國科學院深圳先進技術研究院定量合成生物學全國重點實驗室研究員黃術強團隊與中國農業大學教授朱奎團隊、北京大學研究員黃建永團隊合作,在國際學術期刊《細胞》發表最新研究:團隊通過跨學科協同創新,從“器官幾何結構特征-細胞力信號轉導-病原菌感染”互作機制出發,首次揭示組織形態特征調控細菌感染的新規律。同時團隊提出了基于力敏感離子通道蛋白Piezo1的抗菌策略,為抗菌藥物提質增效、降低毒副作用和指導合理用藥提供了潛在方案,具有重要的臨床應用前景。
力學導航揭秘細菌“精準打擊”
研究團隊通過結合微生物學、力學生物學與生物醫學工程等多學科交叉研究發現,細菌感染并非隨機發生,而是受到宿主組織力學特性的精準控制。通過構建不同組織形態的上皮細胞層模型,探究病原菌與其互作的時空動態過程,團隊揭示了多種病原菌上皮單層中的空間感染規律并非傳統認為的隨機分布,而是呈現出明顯的“邊際效應”,這種感染模式與細胞層的致密程度直接相關——結構越緊密的細胞層,其邊緣區域越易被細菌侵襲,且這一規律不受細胞種類或培養條件影響,打破了傳統認為細菌隨機分布的觀點,表明不同組織形態對細菌感染的空間分布具有重要調控作用。
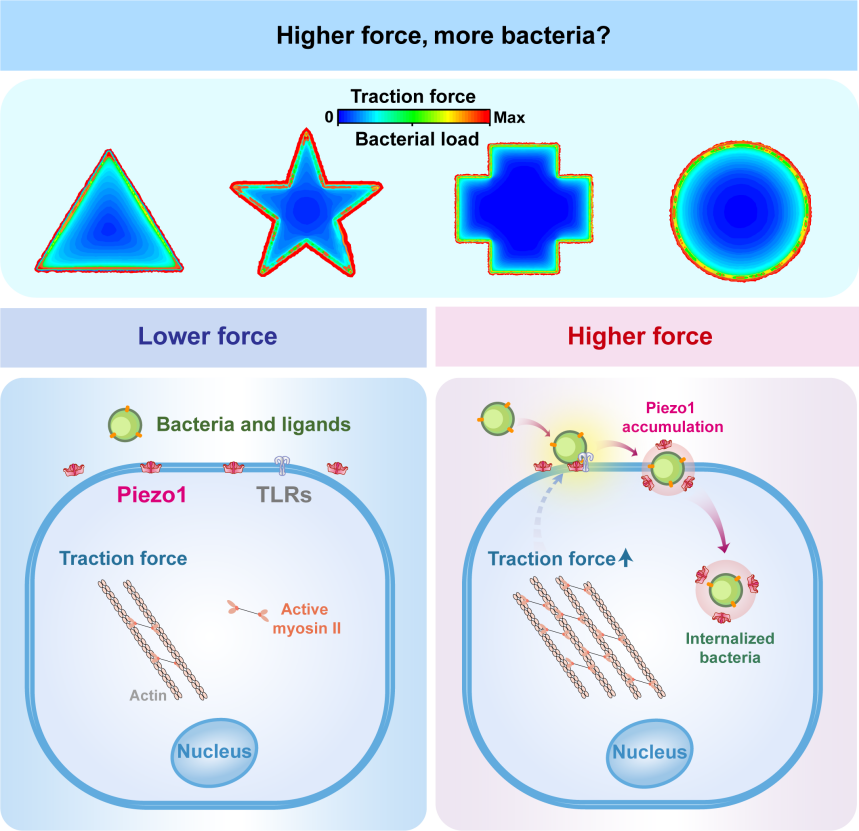
研究團隊進一步通過力學分析模型發現,在上皮細胞層中,細胞牽引力與細菌感染具有高度協同性,高牽引力的細胞邊緣區域更容易被細菌入侵。就像橡皮筋拉伸時兩端受力最大,細胞層邊緣因幾何限制產生的“強拉力”,成為了細菌攻擊的“熱點區域”,這一發現為理解細菌感染的空間選擇性提供了新的視角。
在此基礎上,研究團隊“鎖定”了關鍵蛋白--力敏感性離子通道蛋白 Piezo1的作用:當細菌開始入侵時,這種能感知牽引力的蛋白會像磁鐵一樣聚集到感染部位,形成特殊的囊泡結構。這些囊泡就像“信號放大器”,把細胞受到的牽引力轉化為“生化信號”,促使更多細菌在邊緣區域聚集感染。
這一發現不僅揭示了力學因素“指揮”細菌攻擊位置的精細調控,還指出了一個全新治療方向——通過干擾細胞的力學感應系統(比如阻斷Piezo1蛋白的功能),可能開發出阻止細菌精準定位感染部位的新型藥物策略。
宿主導向抗菌新策略,精準給藥破解腸道感染難題
研究團隊基于以上“力學感應開關”--Piezo1蛋白調控細菌感染的核心發現,創新性提出“力學導航抗菌”雙效策略。第一步靶向力學信號源頭:嘗試將Piezo1作為抗菌靶點,并發現抑制Piezo1的表達和激活均能明顯降低感染組織中的細菌載量。第二步構建“仿生戰場”:建立仿生3D腸道芯片精準復現腸道隱窩結構(類似腸道褶皺深處的隱蔽角落),發現消化道細菌傾向于在隱窩結構中富集,以在感染過程中隱匿在胞質中躲避抗菌制劑的殺傷作用,使傳統藥物難以有效滲透。
為此,團隊開發了靶向隱窩結構的“細菌替身”納米遞藥系統——就像“特洛伊木馬”般,這些納米顆粒外殼模擬耐藥菌的表面特征,內核裝載抗生素。該藥物遞送系統不僅能夠在物理空間上精準靶向感染位點、實現藥物的空間精準遞送,還能提升抗菌藥物在隱窩結構的局部濃度,提高對耐藥菌(如MRSA和VRE)感染的療效,這種“斷其信號源+精準送彈藥”的力學導航療法,為應對耐藥菌感染提供了增效減毒的新范式。
近年來抗生素研發的枯竭加劇了細菌耐藥性對于公共衛生安全的威脅,亟需從多元角度開發新型的抗菌策略。傳統的抗菌制劑研發過程通常僅關注對于細菌的殺傷效果,該研究突破了傳統“以菌為本”的研發思路,轉向“宿主導向”的新模式。該治療策略顯著提升了抗生素抗消化道病原菌感染的療效,不僅豐富了合理用藥手段,也為應對全球耐藥危機提供了創新解決方案。

文章上線截圖
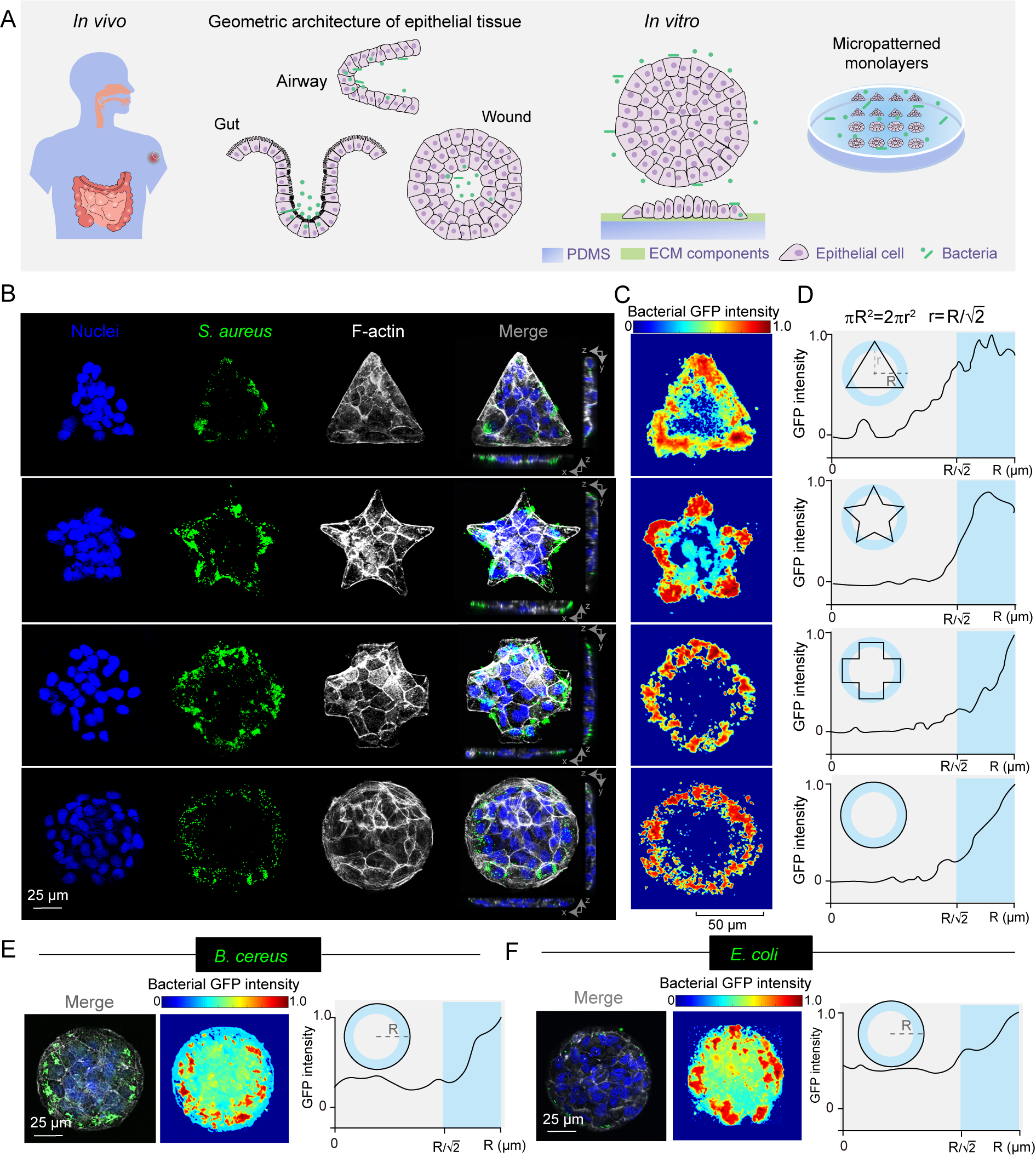
圖1:細菌感染多細胞單層呈現的“邊際效應”
附件下載:


