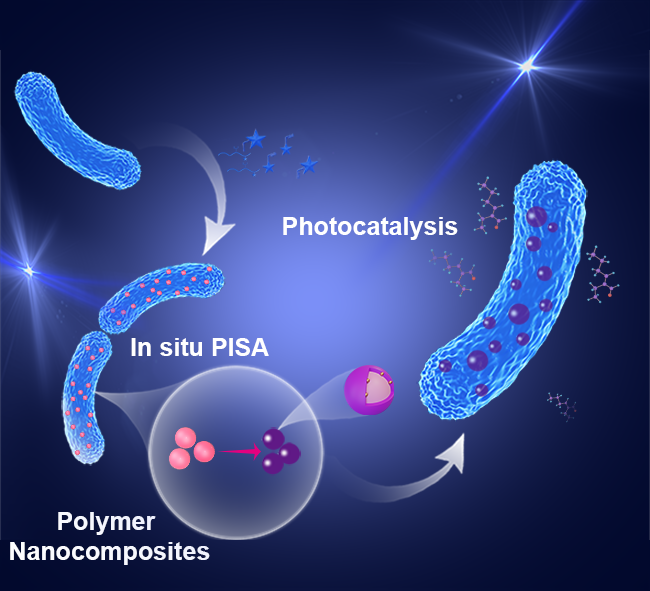
將活體生物系統作為材料合成平臺,已成為功能性納米復合材料研究的一個重要方向。相比傳統的體外合成方法,細胞內原位構建材料具有環境友好、反應溫和、空間控制精確等優勢。因此,如何有效調動細胞這一“天然反應器”的功能,引導其在體內合成復雜納米結構,成為當前亟需攻克的關鍵技術難題。
近期,中國科學院深圳先進技術研究院耿晉研究員團隊在Angewandte Chemie International Edition上發表研究論文,題為“Intracellular Polymerization Induced Self-Assembly and Gold Nanocomposite Synthesis in Living Bacteria”。該工作發展了一種基于細胞內聚合誘導自組裝(iPISA)的新策略,實現了在活大腸桿菌中合成金–聚合物納米復合物,將細菌轉化為“活體納米制造工廠”。
細胞內自組裝的設計與調控
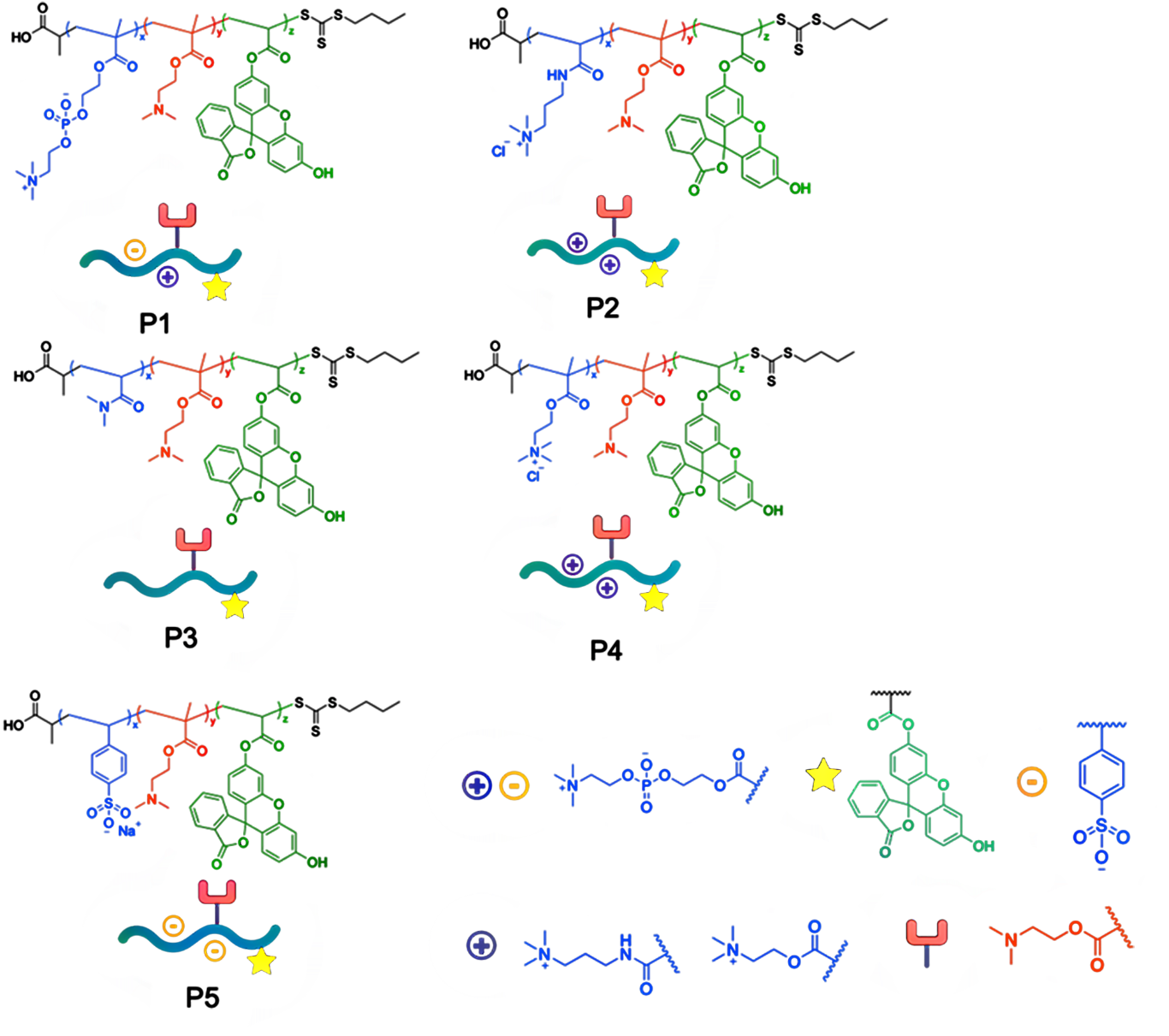
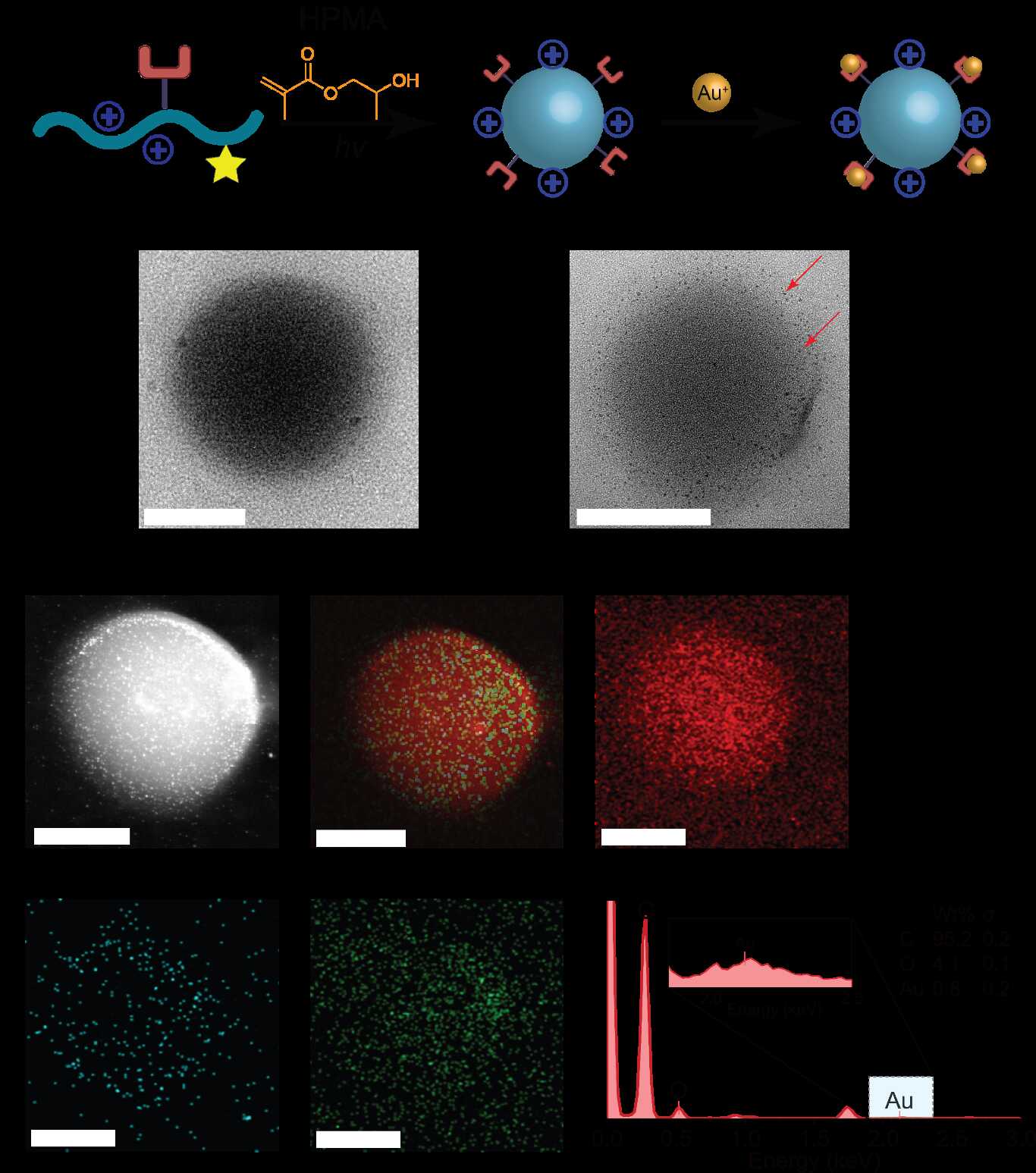
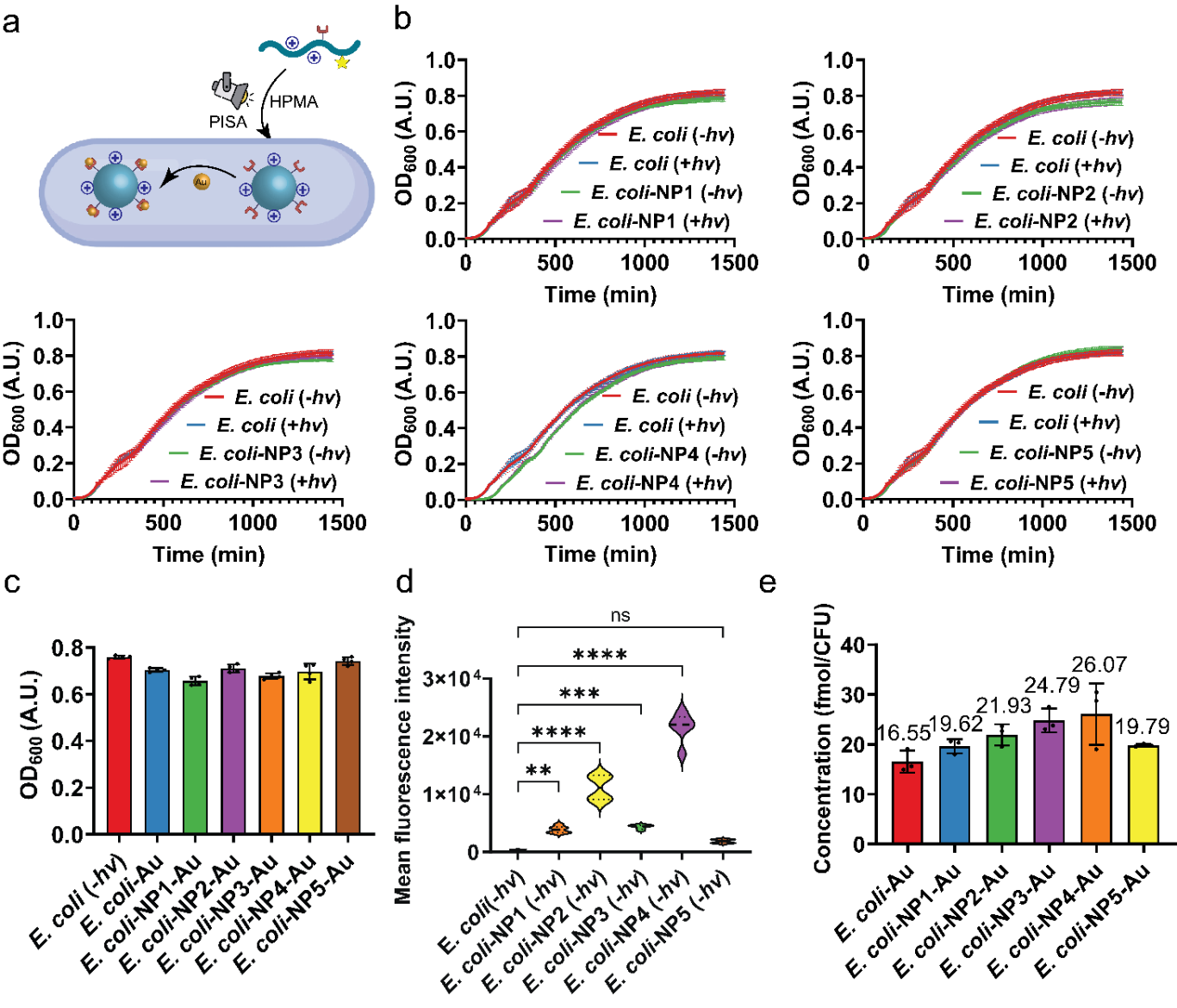
研究團隊設計了一系列結構和電荷性質不同的聚合單體,通過RAFT聚合機制在細胞內引發自組裝。結果發現,不同電荷特性的聚合物與細胞膜的相互作用差異顯著,直接影響材料的空間分布。某些配方更傾向于在細胞內部形成納米復合物,而另一些則主要定位于細胞表面。這一結果為調控納米材料的合成位置提供了可行策略:只需調整反應體系中的關鍵成分,即可實現在胞內或胞外構筑功能材料。
拓展功能:構建細菌-材料雜合體系用于光催化反應
除了材料合成,該體系在功能拓展方面也表現出良好潛力。團隊進一步利用“負載”金-聚合物復合材料的大腸桿菌,開展了光催化反應研究。結果表明,這些“雜合細菌”能夠在溫和條件下催化醛醇縮合反應,有效合成2-乙基己烯醛。此外,復合材料中的金納米顆粒可吸收可見光,激發高能電子,從而提升聚合物材料的光催化活性。在染料羅丹明B的降解實驗中,該體系亦表現出優異效率,顯示出在環境治理領域的應用潛力。
展望與意義
本研究展示了活細菌在納米復合材料原位構建中的獨特優勢,為綠色合成提供了新策略。通過精確調控細胞內外的反應行為,該方法有望在催化、傳感、生物制造等領域實現更廣泛應用。
該工作由中國科學院深圳先進技術研究院耿晉研究員、戴卓君研究員和澳門大學郭珩輝研究員共同通訊,博士研究生張詩玲為第一作者。研究獲得國家自然科學基金、國家重點研發計劃、廣東省珠江人才計劃以及深圳市醫學研究專項等資助支持。

附件下載:


