中國科學院廣州生物醫藥與健康研究院劉勁松課題組等發現新冠病毒引物酶nsp8在溶液中和細胞中都可以發生液-液相分離,且nsp8的相分離特性與聚合狀態相關。相關工作近日以Multiscale characterization reveals oligomerization dependent phase separation of primer-independent RNA polymerase nsp8 from SARS-CoV-2為題在Nature旗下期刊Communications biology上發表。
由于在病毒復制中發揮關鍵作用,并且在宿主中沒有同源蛋白,RNA 依賴的RNA 聚合酶(RdRp)被認為是抗冠狀病毒藥物的作用靶點。冠狀病毒的基因組編碼2種RdRp:引物依賴的RNA聚合酶nsp12和引物合成酶nsp8。科學家們已經揭示了nsp12延伸RNA的分子機制,而nsp8催化引物合成的分子機制尚不明確。
越來越多的研究發現,液-液相分離(LLPS)是形成無膜細胞器和提高細胞內生化反應效率的重要機制。LLPS在諸如新冠病毒等RNA病毒的復制和感染過程中起重要作用。通過蛋白序列和結構分析,劉勁松課題組發現新冠病毒nsp8的催化位點D/ExD/E基序所在的N端結構域是內在無序的。由于內在無序區域在驅動相分離形成中具有重要作用,因此課題組推測新冠病毒nsp8蛋白可能可以發生相分離。
為了研究nsp8的相分離特性,課題組純化了nsp8的二聚體和四聚體,進一步分析發現,這兩種狀態的穩定性都隨緩沖液中鹽濃度的降低而減弱。通過與松山湖實驗室合作,利用中國散裂中子源的小角中子散射儀,課題組測定了nsp8的回旋半徑和流體動力學半徑。通過顯微觀察以及細胞實驗,發現nsp8二聚體可以形成相分離,而nsp8四聚體則在結合RNA后發生相分離。
本研究為nsp8催化引物合成的分子機制研究和抗冠狀病毒藥物研發提供了基礎。
本項研究的合作單位為松山湖材料實驗室和中國散裂中子源。廣州健康院徐進新副研究員和松山湖材料實驗室姜新副研究員為共同第一作者。廣州健康院劉勁松研究員和松山湖材料實驗室王浩教授為共同通訊作者。該研究獲得了中科院青促會、廣州醫科大學廣州呼吸健康研究院、廣州市科技計劃和呼吸疾病國家重點實驗室等的項目支持。
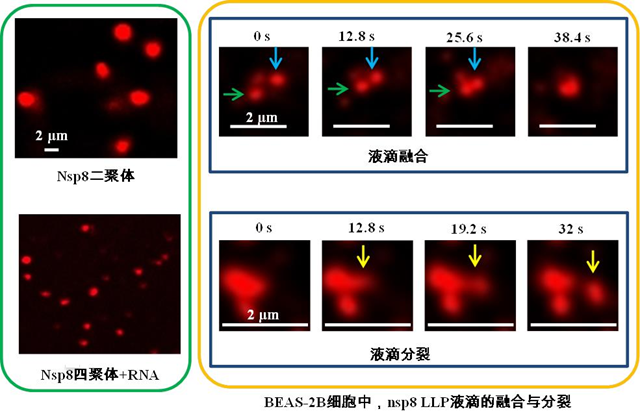
新冠病毒nsp8的液-液相分離
附件下載:


