自然環境變幻莫測,自然界中的動物即使在攝食過程中也需要時刻關注環境中的各種線索,這樣一方面有助于及時發現危險,另一方面也有利于獲取更多資源。由于缺乏細致分析動物多種自發行為的手段,長期以來研究者們主要用攝食量這一指標來評價動物的攝食行為。當前的研究將攝食行為簡化為三個階段:饑餓-尋找食物、攝入食物、飽食-停止攝食[2]。目前已發現數十個腦區的多種神經元參與攝食行為不同階段的神經調控[2-5],然而,關于這些神經元如何平衡動物的各種動機并調控各種自發行為,人們還知之甚少。
3月15日,中國科學院深圳先進技術研究院腦認知與腦疾病研究所王立平團隊在Neuron 雜志在線發表了題為“An iterative neural processing sequence orchestrates feeding” 的研究論文[1],詳細描述了小鼠攝食行為與非攝食行為交替出現的片段化攝食行為特征,并揭示了多群神經元依次調控每次攝食行為的準備、發起和維持的神經機制。

文章上線截圖
王立平團隊利用深度學習算法輔助的行為跟蹤與記錄系統,對小鼠攝入食物這一階段中的自發行為進行了細致研究。通過深度學習算法識別單幀錄像中小鼠的動作,總共識別出14種特征動作,并通過聚類算法將這些動作劃分為8種有意義的行為,進而將這些行為分為攝食、行走和探索環境等三類,并將小鼠在攝入食物這一階段的自發行為描述為“靠近食物、攝食、離開食物、探索環境”等一系列行為的循環。
研究者們通過分析不同自發行為過程中的神經元鈣反應發現,ARCAgRP神經元在小鼠饑餓,環境中有食物,但小鼠在探索環境而沒有去吃的情況下被激活,在靠近食物和攝食過程中被抑制;LHGABA神經元在小鼠發起攝食行為的時候被激活,激活時間與攝食行為持續時間無關;而DRGABA神經元在攝食過程中持續激活,激活時間與攝食時間成強烈的正相關關系,同時這些神經元在小鼠離開食物探索環境時被抑制。
進一步,研究者們利用光遺傳方法驗證了ARCAgRP,LHGABA和DRGABA神經元在小鼠片段化攝食行為中的功能。抑制ARCAgRP神經元會使饑餓小鼠表現出更多的探索環境行為并減少攝食行為,而激活這些神經元,在有食物的情況下會減少探索環境行為而增加攝食行為,但在只有塑料假食物存在的情況下并不影響探索環境行為。先前的研究表明,ARCAgRP神經元編碼負性價值[6]。由此推測,ARCAgRP神經元的功能是,在饑餓情況下對正在進行的與攝食無關的行為進行限制,由此可以使攝食相關動機占據主導地位,從而幫助發起攝食行為。激活LHGABA神經元會使小鼠表現出強烈的啃咬行為,而抑制這些神經元會導致饑餓的小鼠無法啃咬食物。由此推測,LHGABA神經元介導了攝食行為的發起。激活DRGABA神經元會顯著延長小鼠的攝食行為,而抑制這些神經元會顯著縮短攝食行為,由此推測,DRGABA神經元參與調控攝食行為的維持。
因此,ARCAgRP,LHGABA和DRGABA神經元分別調控片段化攝食行為的準備、發起和維持。
與小鼠類似,人類也存在片段化攝食的現象,在攝食過程中并不會一直關注食物,而是會不斷關注周圍環境。集中時間吃飯是社會化訓練的結果,幼童會一邊吃飯一邊玩耍,而成人通常在吃飯的同時進行社交活動。這項研究加深了人們對攝食行為和攝食過程中神經調控機制的認識,將為攝食障礙相關疾病的治療提供新的理論基礎。
本研究建立的行為精細分析方法也適用于各種其他本能行為的研究。動物的各種本能行為都包含多種動機相互競爭,行為發起、維持以及被其他動機所干擾而中斷等過程,在這個過程中也會涉及多群神經元的分工合作。外界環境和動物的內在狀態會對各群神經元的反應模式進行動態調控,從而實現對動物行為的調控,使得動物可以適應環境,生存繁衍。本研究為解析多種本能行為各階段的精細神經調控機制打下了基礎,為深入理解動物在自然選擇中形成的本能行為策略的神經計算機制提供了理論框架,將為通用人工智能的發展提供更多的理論依據。
深圳先進院王立平研究員為該論文的通訊作者,助理研究員劉清晴、高級工程師楊星和先進院與港城大聯合培養博士生羅墨軒為論文的共同第一作者。港城大Rosa Chan副教授等人也參與了本項工作。論文還得到了新加坡科技研究局(A*STAR)傅玉教授等人的寶貴意見,并獲得國家自然科學基金委,廣東省重點領域研發計劃等項目的資助。
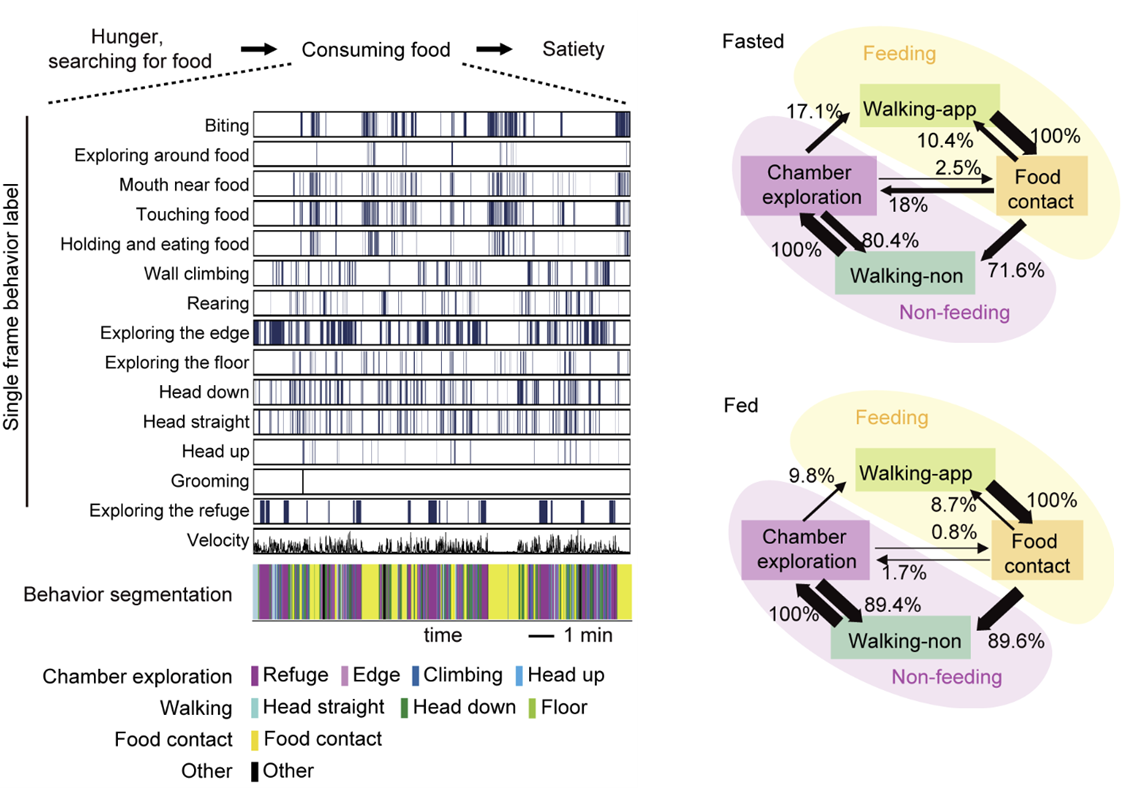
利用深度學習輔助的行為分析系統解析小鼠的片段化進食行為
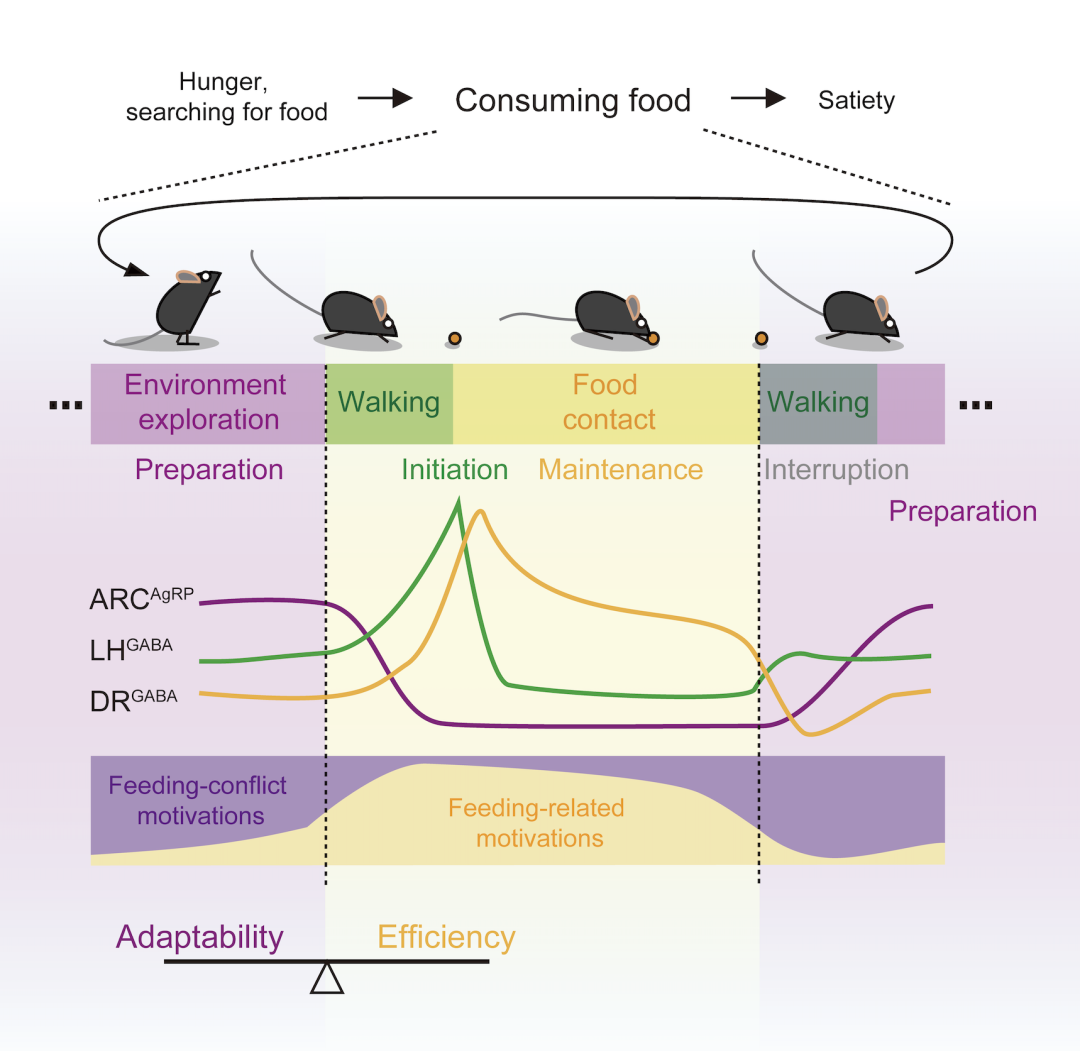
攝食片段的準備、發起與維持分別由ARCAgRP,LHGABA和DRGABA神經元調控
參考文獻
1. Liu, Q., Yang, X., Luo, M., Su, J., Zhong, J., Li, X., Chan, R.H.M., and Wang, L. (2023). An iterative neural processing sequence orchestrates feeding. Neuron 1–15
2. Alcantara, I.C., Tapia, A.P.M., Aponte, Y., and Krashes, M.J. (2022). Acts of appetite: neural circuits governing the appetitive, consummatory, and terminating phases of feeding. Nat. Metab. 4, 836–847. 10.1038/s42255-022-00611-y.
3. Duerrschmid, C., He, Y., Wang, C., Li, C., Bournat, J.C., Romere, C., Saha, P.K., Lee, M.E., Phillips, K.J., Jain, M., et al. (2017). Asprosin is a centrally acting orexigenic hormone. Nat. Med. 23, 1444–1453. 10.1038/nm.4432.
4. Li, Y., Zhong, W., Wang, D., Feng, Q., Liu, Z., Zhou, J., Jia, C., Hu, F., Zeng, J., Guo, Q., et al. (2016). Serotonin neurons in the dorsal raphe nucleus encode reward signals. Nat. Commun. 7. 10.1038/ncomms10503.
5. Li, Y., Zeng, J., Zhang, J., Yue, C., Zhong, W., Liu, Z., Feng, Q., and Luo, M. (2018). Hypothalamic Circuits for Predation and Evasion. Neuron 97, 911-924.e5. 10.1016/j.neuron.2018.01.005.
6. Betley, J.N., Xu, S., Cao, Z.F.H., Gong, R., Magnus, C.J., Yu, Y., and Sternson, S.M. (2015). Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature 521, 180–185. 10.1038/nature14416.
附件下載:


