4月24日,中國科學院深圳先進技術研究院合成生物學研究所Jay Keasling團隊湯紅婷副研究員與羅小舟研究員團隊合作在Metabolic Engineering上發表了題為《Systematic genetic modifications of cell wall biosynthesis enhanced the secretion and surface-display of polysaccharide degrading enzymes in Saccharomyces cerevisiae》的研究成果。在該工作中,研究人員基于合成生物學策略,系統性地探究釀酒酵母細胞壁生物合成途徑中關鍵基因對分泌和表面展示BGL1酶活性的影響,篩選能夠提高重組酶活性的新基因改造靶點,進而組合改造新基因靶點,進一步提高了重組酶的活性。同時,該研究通過蛋白質組學和逆向工程分析發現,參與蛋白翻譯和分泌途徑的關鍵基因上調表達對提高重組酶分泌和表面展示活性具有重要作用。這項研究為構建酵母細胞工廠高效分泌和展示重組蛋白提供了新思路。本文的第一作者為研究助理陳南柱、碩士學生楊碩和研究助理尤大偉,湯紅婷副研究員和羅小舟研究員為論文通訊作者。


文章上線截圖
文章鏈接:https://doi.org/10.1016/j.ymben.2023.04.011
利用農業廢棄物等廉價碳源生產生物能源、天然產物、大宗化學品等具有附加價值的化學物質是有助于實現“碳中和”的工業生產策略。纖維素、淀粉等多糖是重要成分,但由于生物利用過程的效率限制,往往導致其不能被充分利用。釀酒酵母作為傳統的模式真核生物,常用于分泌表達或表面展示具有不同功能的蛋白,其中其胞外表達纖維素酶、淀粉酶等多糖水解酶,可以將這些廉價碳源通過生物統合加工過程(Consolidated Bioprocess, CBP)轉化為高附加值產品。改造釀酒酵母分泌途徑(secretory pathway)提高重組蛋白胞外產量是眾所周知的方案之一。而細胞壁生物合成過程緊密地調控蛋白分泌途徑,然而,它對重組蛋白胞外表達活性的影響卻較少被報道。
在本研究中,作者首先選取來自Saccharomycopsis fibuligera的β葡萄糖苷酶(β-glucosidase, BGL1)作為報告蛋白,以其分泌(secretion, sBGL1)和表面展示表達的活性(surface-display, dBGL1)作為指標,系統性地評估了79個參與細胞壁合成基因的敲除對sBGL1和dBGL1活性的影響。經過96深孔板培養篩選以及搖瓶發酵二次驗證后發現,DFG5、YPK1、FYV5以及CCW12或KRE1基因的失活,能夠顯著提高sBGL1或dBGL1的活性(>40%)(圖1)。
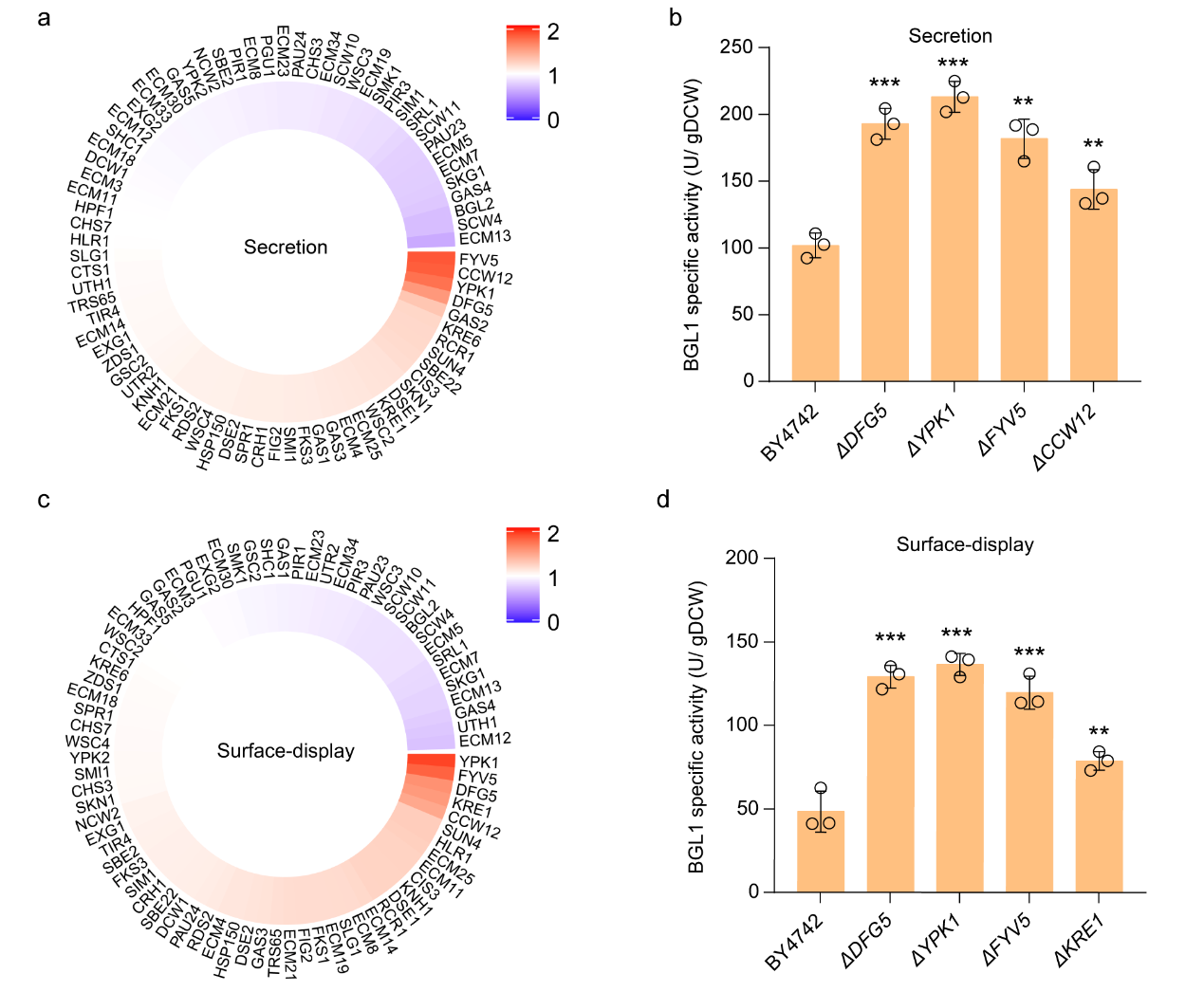
圖1. 細胞壁生物合成基因失活對BGL1活性的影響。
隨后,為了進一步探究上述基因的改造是否存在組合效應,該研究對上述基因靶點進行組合敲除,包括雙敲除,三敲除和四敲除。通過分析其對分泌和表面展示BGL1活性的影響發現,FYV5和CCW12雙敲除菌株表現出最優的BGL1胞外表達能力,其sBGL1和dBGL1活性相較野生型菌株分別提升了4.41和5.14倍(圖2)。
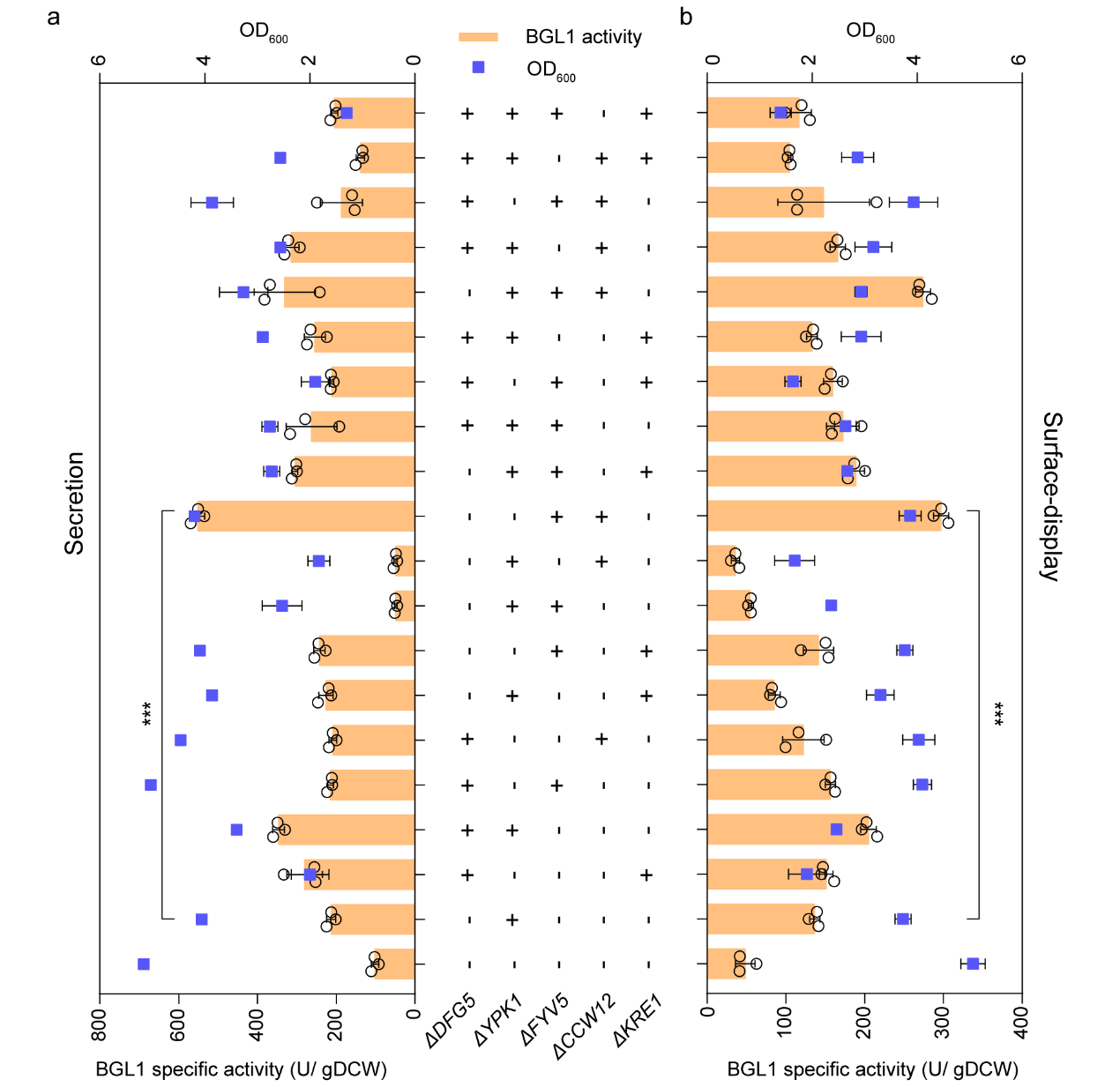
圖2. 細胞壁生物合成的組合改造進一步提高sBGL1(a)和dBGL1(b)的活性
一般,富營養培養基YP對蛋白胞外表達具有促進作用,因此,該研究也測試了FYV5和CCW12雙敲除菌株在YP條件下重組酶胞外表達活性的變化。結果顯示,在YP中sBGL1和dBGL1活性分別提升了31.68%和46.55%。
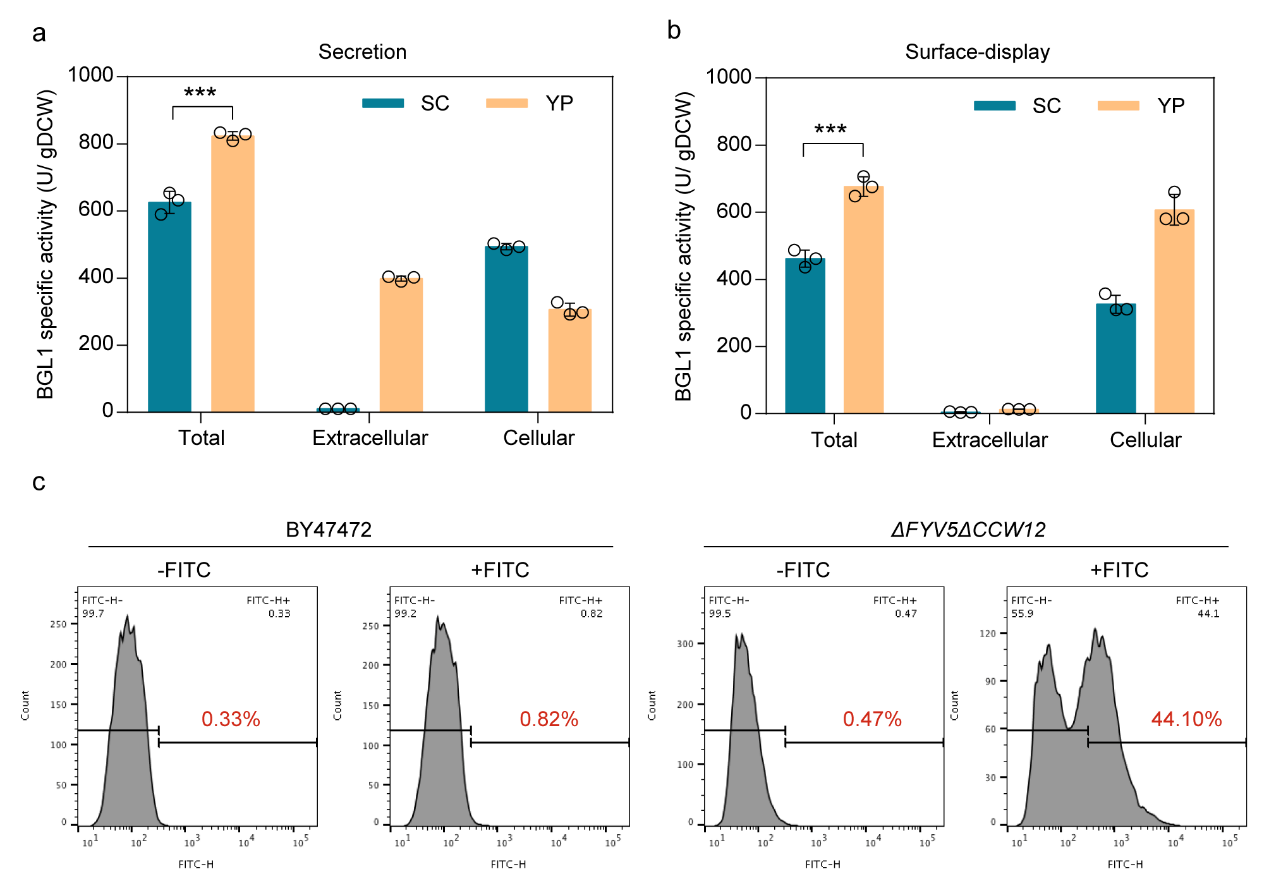
圖3. 富培養基YP使ΔFYV5ΔCCW12菌株分泌和表面顯示BGL1活性進一步增強。
為了驗證改造細胞壁合成途徑具有普適性,該研究測試了FYV5和CCW12雙敲除對不同錨定蛋白(Sed1p, Dan4p, Aga1p)和不同重組酶的影響。研究結果顯示,FYV5和CCW12雙敲除能提高使用不同錨定蛋白的BGL1活性,也能促進使用同一錨定蛋白的不同重組酶的活性(圖4),包括纖維二糖水解酶(cellobiohydrolase, CBH1)和淀粉酶(Amylase)。
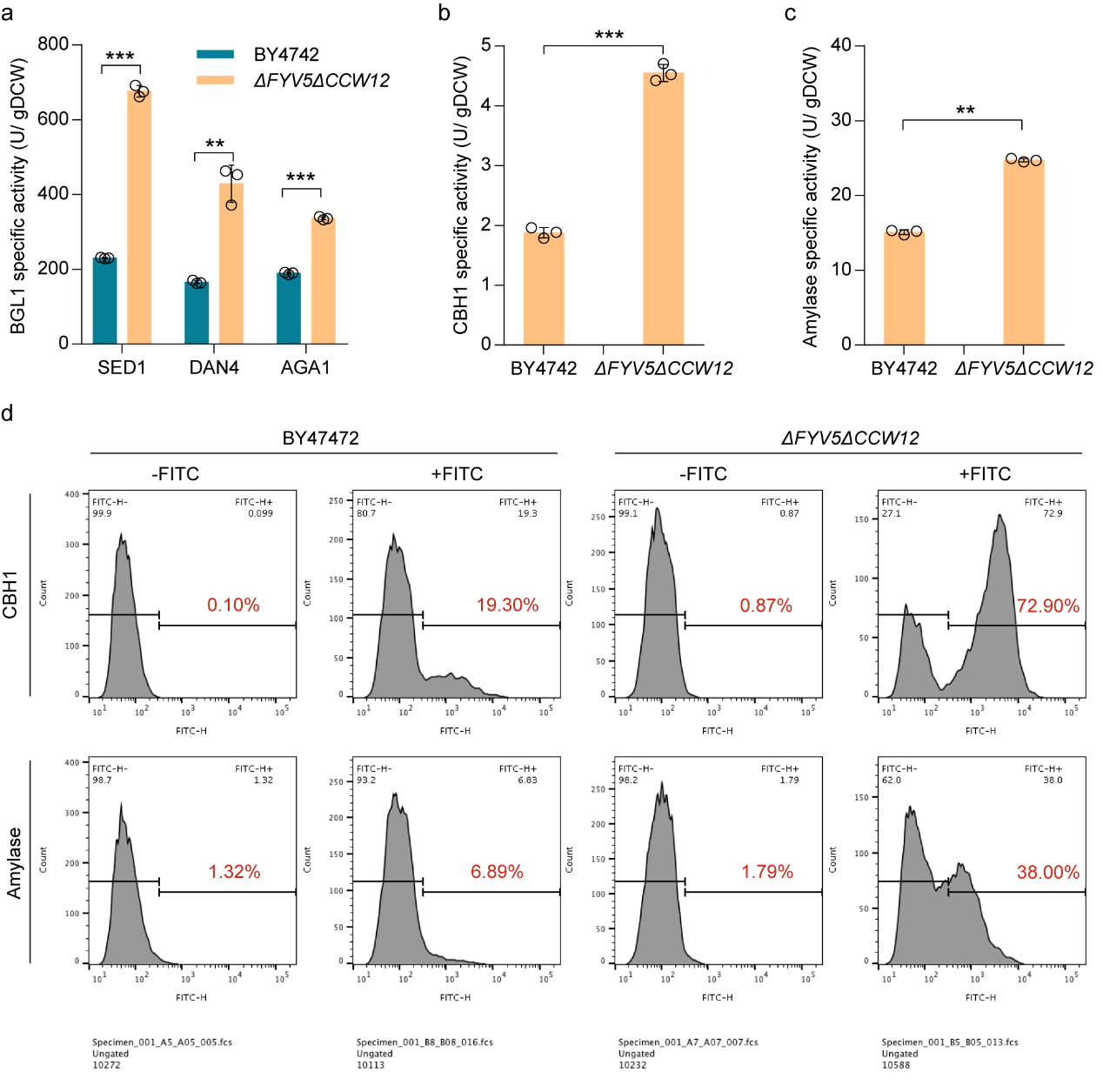
圖4. 細胞壁生物合成改造后的菌株提升不同重組酶的活性
為了探究FYV5和CCW12雙敲除菌株提升重組酶胞外表達的潛在機制,該研究對改造菌株和野生型菌株進行了蛋白質組學測試,發現FYV5和CCW12雙敲除能引發系列蛋白的上調表達,除了分泌途徑關鍵節點—內質網蛋白加工過程(protein processing in the ER),蛋白翻譯(protein processing in the ER and protein translation)過程也是主要的被調控模塊之一(圖5)。通過逆向代謝工程研究發現,過表達12個蛋白翻譯過程的蛋白,能提高BGL1胞外活性,其中,過表達RPL8B、DBP1、TIF3、ETT1和SUI3能將BGL1活性分別提高6.8、2.7、1.7、1.2和1.1倍(圖5c)。
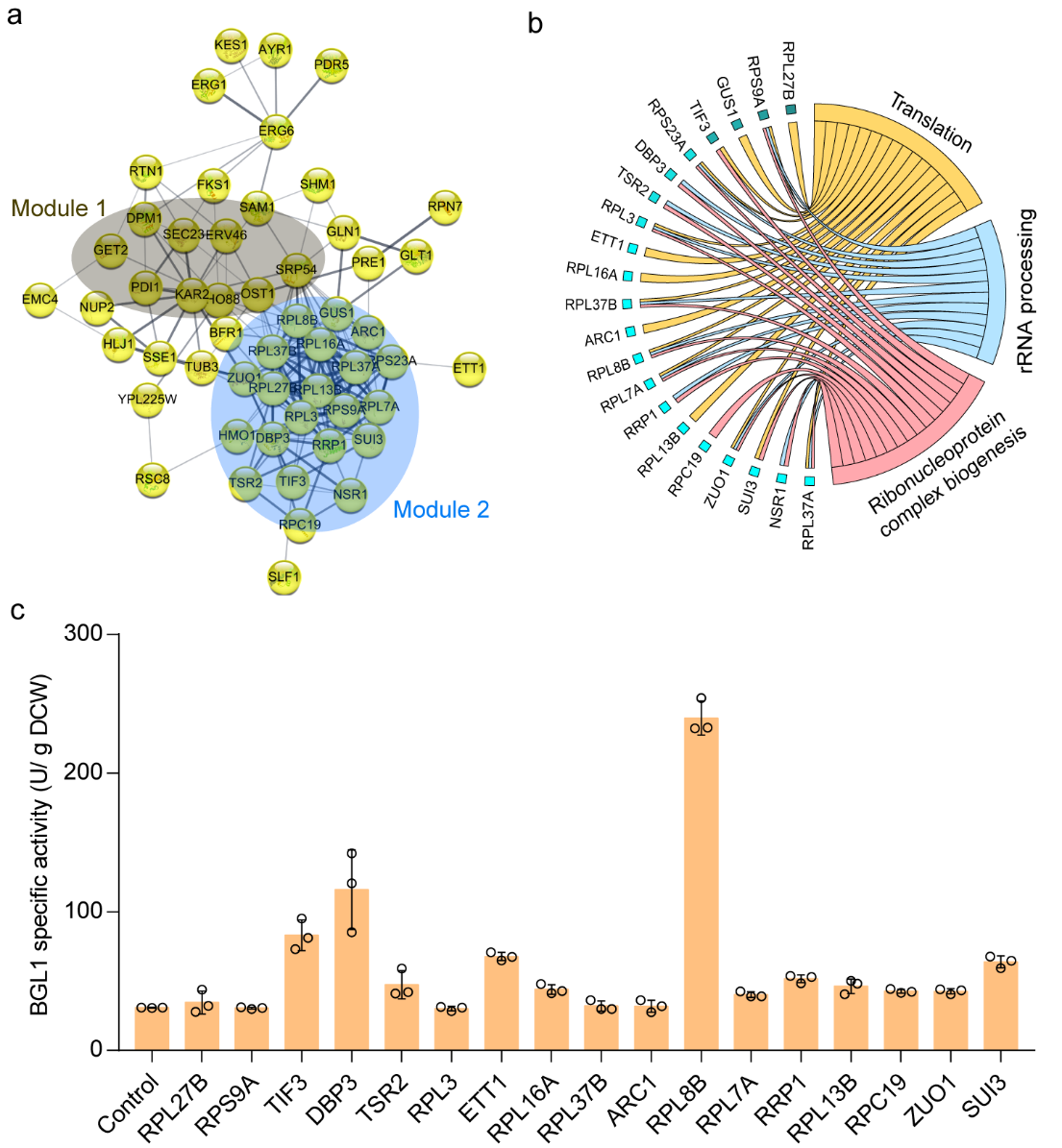
圖5. 通過蛋白質組學分析和逆向代謝工程揭示改造細胞壁生物合成途徑提高重組酶活性的機制。
綜上所述,研究人員系統地探究釀酒酵母細胞壁生物合成途徑對重組蛋白胞外表達的影響,發現數個新的靶點的改造能顯著提高重組酶胞外酶活,包括DFG5、YPK1、FYV5、CCW12和KRE1。通過特定基因的組合改造和培養基的優化,使釀酒酵母胞外表達重組酶分泌和展示活性得到了大幅度的增強,分別提高了6.13倍和7.99倍。最后,通過蛋白質組學分析偶聯逆向工程策略,揭示蛋白翻譯過程是改造菌株高效表達重組酶的重要調控之一。這項研究為高效構建酵母細胞工廠提供了新思路。
致謝
這項工作得到了國家自然科學基金(31901030)、廣東省基礎與應用基礎研究基金(2021A1515010842)及深圳合成生物學創新研究院的支持。同時,研究人員對深圳先進技術研究院合成基因組學中心戴俊彪客座研究員提供的酵母敲除菌株庫致以誠摯的感謝。
附件下載:


