哺乳動物骨髓由多種類型的細胞組成,包括脂肪細胞、成骨細胞、破骨細胞、基質(zhì)細胞和血管內(nèi)皮細胞。這些細胞之間的相互作用為骨髓干細胞(也稱為基質(zhì)或間充質(zhì)干細胞,BMSCs)和其他譜系細胞的分化提供了關(guān)鍵的調(diào)節(jié)環(huán)境。成骨細胞和骨髓脂肪細胞(bone marrow adipocytes,BMAds)雖然功能和形態(tài)上不同,但都起源于同一前體細胞——BMSCs。骨髓脂肪組織(MAT)是骨髓的重要組成部分,具有能量儲存和內(nèi)分泌調(diào)節(jié)功能,對于維持骨穩(wěn)態(tài)至關(guān)重要。然而,骨髓脂肪細胞的過度積累與骨質(zhì)惡化有關(guān),通常被認為不利于骨髓微環(huán)境的穩(wěn)態(tài)。
近日,中國科學(xué)院深圳先進技術(shù)研究院管敏研究員課題組(課題組博士后黃童齡為本文的第一作者)在Nature Communications發(fā)表了題為“Targeting adipocyte ESRRA promotes osteogenesis and vascular formation in adipocyte-rich bone marrow ”的研究論文,脂肪細胞中的雌激素相關(guān)受體α(estrogen-related receptor α,ESRRA)通過正調(diào)控leptin和反向調(diào)節(jié)分泌型磷蛋白 1(secreted phosphoprotein 1,Spp1)的表達和分泌,從而影響骨髓中富含脂肪細胞的骨生成和血管形成。同時,探討ESRRA作為治療骨質(zhì)疏松的潛在靶點的可能性。

文章上線截圖
有研究表明,高脂肪飲食(HFD)誘導(dǎo)肥胖小鼠通過循環(huán)瘦素(leptin)作用于表達瘦素受體(LepR+)的BMSCs,促進脂肪形成,抑制BMSCs成骨,從而加速MAT的擴張。因此,病理條件導(dǎo)致骨微環(huán)境中異常信號的存在,驅(qū)動BMSCs分化命運轉(zhuǎn)變,即成脂分化增強而成骨分化減少,從而導(dǎo)致骨量減少、骨微結(jié)構(gòu)破壞和MAT堆積。事實上,在多種臨床病理情況下,如肥胖、糖尿病、神經(jīng)性厭食癥、糖皮質(zhì)激素治療、放療、更年期和衰老,骨量減少常伴隨著MAT的異常擴增。然而,這些異常擴增的BMAds如何介導(dǎo)骨髓駐留細胞行為的確切機制仍然難以確定。
BMAds位于骨髓微環(huán)境中,與血管和造血系統(tǒng)密切接觸。2014年Ralf Adams教授課題組在Nature上發(fā)表“背靠背”研究論文,證實骨組織中存在一種特異性血管亞型——H型(CD31hiEMCNhi)血管,它們與骨祖細胞關(guān)聯(lián),支持骨形成,H型血管異常與衰老和絕經(jīng)后的骨質(zhì)疏松癥發(fā)生發(fā)展相關(guān)。BMAds可分泌多種分泌因子,包括leptin、脂聯(lián)素(adiponectin)和干細胞因子(SCF)等,從而參與骨髓微環(huán)境中骨生成、血管形成和造血功能的穩(wěn)態(tài)維護。因此,BMSCs分化命運的改變(成骨減少、成脂增加)和血管形成障礙是導(dǎo)致骨質(zhì)疏松癥的重要影響因素。然而,這些同時發(fā)生的具體調(diào)控機制仍有待深入闡明。
在本研究中,研究人員發(fā)現(xiàn)在高脂飲食介導(dǎo)肥胖和卵巢切除介導(dǎo)雌激素缺乏的病理條件下,小鼠主要表現(xiàn)為骨量減少伴隨骨髓脂肪細胞數(shù)量增加;同時,骨骺端生長板下H型血管密度降低且血管結(jié)構(gòu)和形態(tài)異常,以及周圍成骨前體細胞數(shù)量明顯減少。以轉(zhuǎn)錄因子ESRRA為研究對象,利用Adiponectin-Cre工具鼠構(gòu)建了成熟脂肪細胞特異性ESRRA敲除小鼠模型。
通過系統(tǒng)的骨形態(tài)計量學(xué)和組織學(xué)分析,發(fā)現(xiàn)條件性敲除脂肪細胞Esrra基因能夠明顯增加骨微環(huán)境中骨祖細胞數(shù)量,促進骨形成,并且增強骨髓H型血管形成,從而明顯改善骨質(zhì)丟失。進一步機制研究發(fā)現(xiàn),骨髓脂肪細胞中ESRRA直接與leptin基因啟動子上的ESRRA反應(yīng)元件(ERRE)結(jié)合,增強其轉(zhuǎn)錄表達和分泌。此外,ESRRA干擾E2/ESR1驅(qū)動的Spp1啟動子激活,從而下調(diào)SPP1的表達和分泌。條件性敲除ESRRA后,通過抑制脂肪細胞leptin的表達和分泌,增強骨髓LepR+BMSCs的成骨分化,進而抑制BMAds的擴增。同時,BMAds或白色脂肪細胞分泌的SPP1可錨定骨髓,發(fā)揮促血管內(nèi)皮細胞遷移和血管新生的作用,同時增加骨祖細胞在骨骺端 H 型血管周圍的聚集和分化,最終促進骨形成。
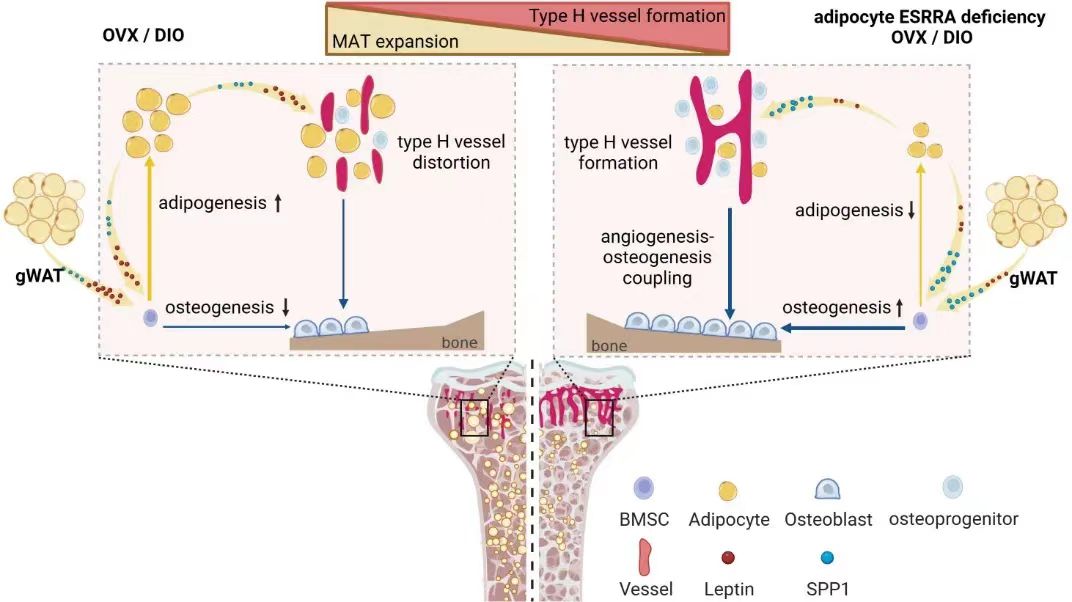
脂肪細胞ESRRA調(diào)控leptin和SPP1表達及分泌影響骨質(zhì)疏松病理性微環(huán)境的骨髓脂肪擴張和成骨成血管作用
研究結(jié)果表明了脂肪細胞ESRRA可通過調(diào)控BMSCs成骨成脂分化方向以及H型血管的形成,改善肥胖/雌激素缺乏所導(dǎo)致的骨丟失。因此,進一步建立高脂誘導(dǎo)肥胖和骨丟失小鼠模型,并喂食ESRRA特異性拮抗劑Compound 29。實驗結(jié)果顯示,經(jīng)治療后的小鼠骨形成能力顯著增強,骨髓脂肪細胞顯著減少,有效抵抗肥胖小鼠的骨丟失和BMAds異常擴增。綜上所述,該研究揭示了病理性骨微環(huán)境中,脂肪細胞ESRRA調(diào)控分泌因子影響B(tài)MSCs成骨成脂分化命運及血管內(nèi)皮細胞的血管生成,提示骨髓脂肪細胞ESRRA是潛在的藥物靶點,為治療骨質(zhì)疏松癥等骨疾病提供了新途徑。
附件下載:


