靶向蛋白質降解技術在生物醫學領域具有巨大潛力,尤其是在治療腫瘤和其他蛋白質相關疾病方面。利用分子膠和PROTAC技術降解細胞內蛋白的研究處于領先地位,而通過溶酶體途徑降解膜蛋白和胞外蛋白及其它大分子的研究仍處于臨床前階段。可利用靶點的匱乏極大地限制了技術的進步,因此探索新的、潛在有效的溶酶體靶向降解策略至關重要。
6月20日,中國科學院深圳先進技術研究院醫藥所耿晉團隊在Journal of the American Chemical Society上發表了題為“Lysosome Targeting Chimaeras for Glut1-Facilitated Targeted Protein Degradation”的研究成果。這項工作創新性地利用葡萄糖轉運蛋白Glut1作為溶酶體靶向受體,設計了Glut1促進溶酶體降解(GFLD)策略。通過可逆加成-斷裂鏈轉移(RAFT)聚合制備了潛在的Glut1配體,并通過生物正交反應合成了抗體-糖寡聚物共軛物,將其作為溶酶體靶向蛋白降解分子,用于治療PD-L1高表達的三陰性乳腺癌。本研究證明了葡萄糖轉運體Glut1作為一種溶酶體靶向受體,在生物醫學領域有著更廣泛應用的潛力。
文章上線截圖
鑒于糖轉運蛋白對采用吡喃糖環椅構型的戊糖和己糖的D-立體異構體(如D-葡萄糖、D-半乳糖)具有很強的特異性,研究團隊選擇以D-葡萄糖和D-半乳糖為基礎制備了帶丙烯酰胺的糖單體,并進一步通過可逆加成斷裂鏈轉移(RAFT)聚合制備了五種含糖寡聚物。五種寡聚物隨后被作為候選的葡萄糖轉運蛋白Glut1配體進行了體外實驗,包括用Glut1蛋白和五種糖鏈進行分子對接與計算模擬、結合親和力測試,并通過細胞實驗篩選出細胞攝取量高的配體來合成溶酶體靶向嵌合體分子。
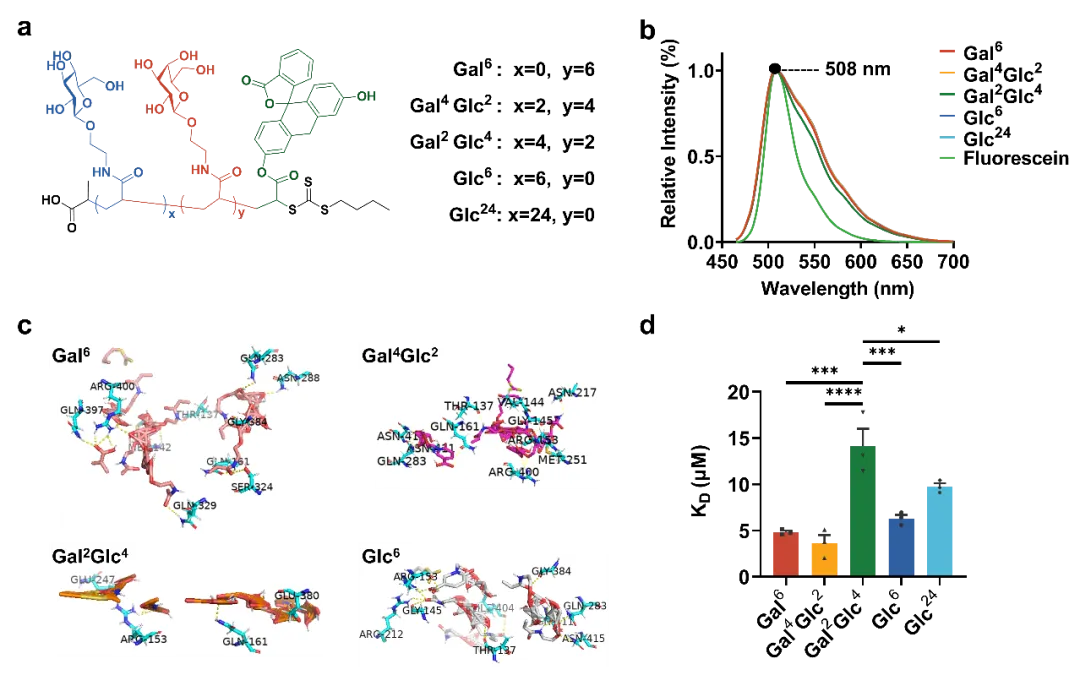
圖1. 有潛力的Glut1配體的表征
由于人源三陰性型乳腺癌細胞系MDA-MB-231和MCF-7具有Glut1高表達的特點,因此本研究以之為細胞模型開展體外實驗。體外篩選分為三個部分,先通過細胞流式實驗比較細胞對五種候選配體的攝取情況,結果表明Gal6,Gal4Glc2和Glc6這三種糖寡聚物的內化程度較高,通過激光掃描共聚焦顯微鏡觀察上述三種配體與溶酶體的共定位情況,發現攝取量高的三種糖寡聚物內化進入細胞后與溶酶體的共定位程度也較高。
鑒于這一結果推測這三種糖寡聚物的內化途徑與溶酶體相關,因此團隊進一步通過細胞流式實驗探究配體的攝取途徑,證明了糖寡聚物在細胞中的攝取是通過溶酶體途徑且與Glut1相關。綜合上述細胞實驗結果,研究團隊篩選出了有潛力的Glut1配體Gal6,Gal4Glc2和Glc6進行下一步的溶酶體靶向嵌合體分子合成。

圖2. 在MDA-MB-231細胞系中篩選Glut1配體
研究團隊以MDA-MB-231細胞系高表達的免疫檢查點PD-L1為目標蛋白,選取內化有限的PD-L1抗體Avelumab進行Ave-糖寡聚物共軛物分子的合成。通過三個經典的正交反應將篩選出的有潛力的Glut1配體Gal6、Gal4Glc2和Gal6分別連接到抗體Avelumab上,得到三種有潛力的溶酶體靶向嵌合體分子。通過CCK8檢測法評估了三種Ave-糖寡聚物共軛物分子對MDA-MB-231細胞的毒性作用,確保細胞中PD-L1的減少并非由于Ave-糖綴合物分子的細胞毒性引起。隨后通過免疫印跡法和免疫熒光檢測驗證了三種Ave-糖綴合物都是有潛力的能適度降解PD-L1的蛋白降解劑,其中Ave-Gal6的降解效果最佳。

圖3. Ave-糖寡聚物共軛物的蛋白質降解活性具有濃度依賴性
此外,免疫印跡檢測的結果顯示PD-L1和Glut1的蛋白表達量隨處理時間的延長具有一致的變化趨勢,對此研究團隊認為在逆轉運復合體的作用下,Glut1有從溶酶體逃逸并返回細胞膜表面的行為,進而引發PD-L1-Ave-糖寡聚物-Glut1復合物也被帶回到膜上,導致PD-L1蛋白的降解效果尚有提升空間。
團隊進一步探討了Ave-糖綴合物降解 PD-L1蛋白的降解機制是否與糖寡聚物內化進入細胞的途徑相關,免疫印跡實驗結果顯示Ave-糖寡聚物共軛物分子降解PD-L1蛋白是通過溶酶體途徑介導,并且揭示了Glut1在此策略中扮演了重要角色,相信葡萄糖轉運蛋白Glut1將在未來的靶向蛋白降解技術中得到更廣泛的應用。
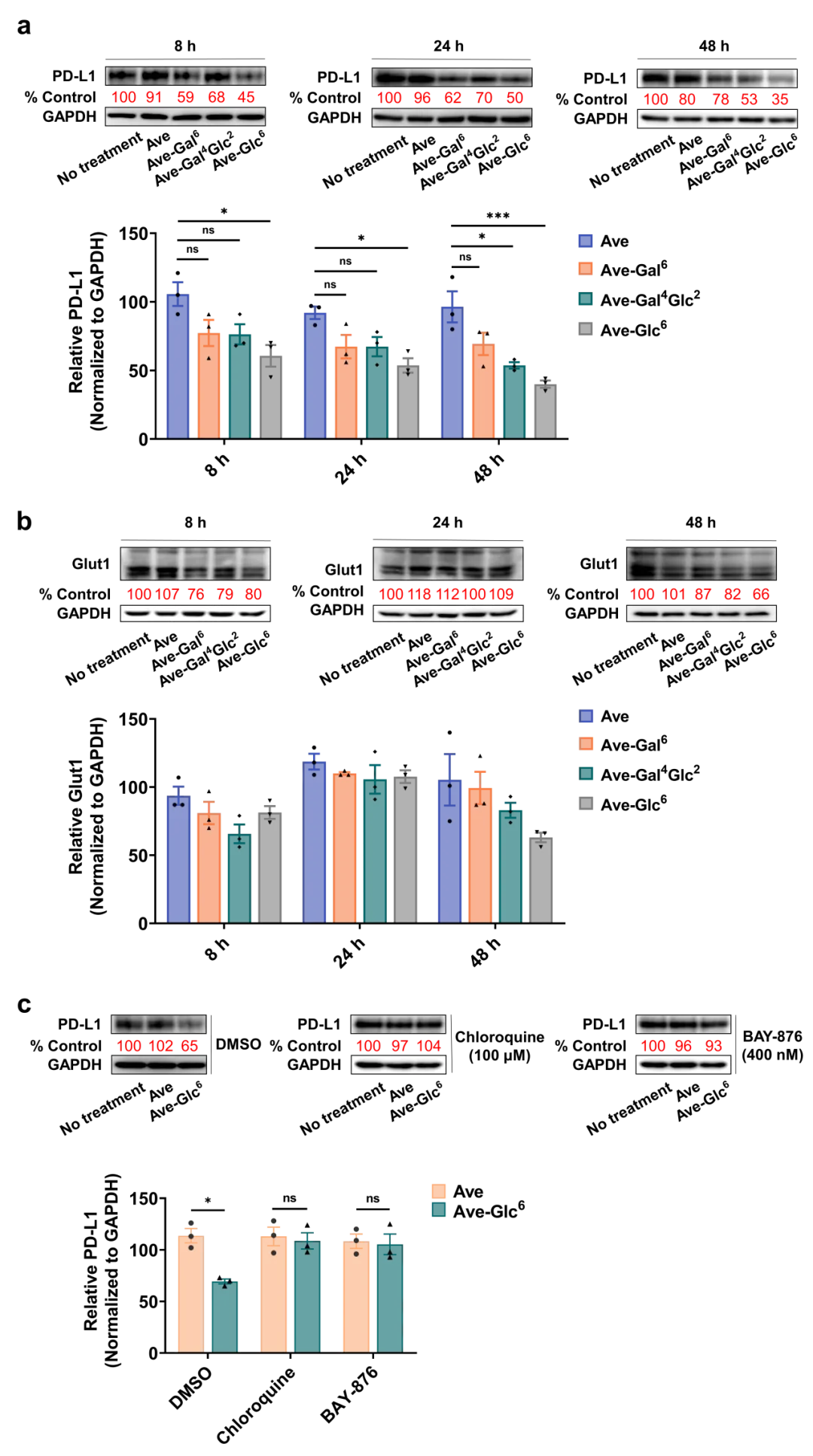
圖4. Ave-糖寡聚物共軛物靶向蛋白降解效率隨時間的變化情況及其降解機制
綜上所述,本研究成功開發了基于溶酶體靶向嵌合體技術的蛋白質降解劑,為腫瘤治療提供了新的治療思路,并成功驗證了葡萄糖轉運蛋白Glut1是一種適用于蛋白質降解技術的溶酶體靶向受體,創新性地提出了Glut1促進溶酶體途徑的蛋白降解(GFLD)策略,用于靶向降解膜蛋白,為蛋白質降解技術的發展鋪平了道路。目前,很多蛋白結合力好但內化效果欠佳的抗體無法充分發揮價值,利用Glut1促進溶酶體途徑的蛋白降解策略有望在不久的將來改善這些抗體的內化效果,預計這將大大推進抗體偶聯藥物的開發進程,拓展抗體在醫學領域的應用場景,并提高臨床轉化率。
中國科學院深圳先進技術研究院耿晉研究員為本文的通訊作者,碩士研究生羅錦妍和高權博士為文章共同第一作者。該研究獲得了國家自然科學基金、廣東省自然科學基金、中國科學院國際合作項目的支持。
附件下載:


