近日,中國科學院南海海洋研究所熱帶海洋生物資源與生態重點實驗室王曉雪研究員團隊發現逆轉錄酶通過“重編輯”溫和噬菌體的基因組賦予其超感染能力,具有超感染能力的噬菌體在生物膜中實現快速增殖。相關研究成果以“A reverse transcriptase controls prophage genome reduction to promote phage dissemination in Pseudomonas aeruginosa biofilms”為題,10月20日在線發表于Cell子刊Cell Reports。南海海洋所研究員郭云學,2022級博士研究生林世團為該論文共同第一作者,研究員王曉雪為通訊作者。
在生物界的漫長進化歷程中,逆轉錄酶的發現改變了對遺傳信息傳遞方式的認識。在許多真核生物中,端粒酶逆轉錄酶通過逆轉錄將端粒DNA加至真核細胞染色體末端,填補DNA復制損失的端粒,以保護基因組的完整性。在逆轉錄病毒(RNA病毒)中,逆轉錄酶將病毒RNA逆轉錄合成雙鏈DNA,雙鏈DNA被整合酶整合至宿主細胞染色體DNA上形成前病毒,并可隨宿主細胞分裂傳遞給子代細胞。
研究團隊發現單鏈DNA病毒-絲狀噬菌體的基因組攜帶了逆轉錄酶,通過對生物膜形成中的絲狀噬菌體“釋放-再次侵染”過程的詳細解析,意外的發現該逆轉錄酶負責合成了一個精簡的絲狀噬菌體基因組,舍棄了約1/3的基因組。這個重編輯的噬菌體基因組保留了噬菌體組裝的必需基因,并截獲激活因子上游ncRNA的強啟動子確保噬菌體激活因子及其下游基因的高表達,重編輯的噬菌體基因組還丟掉了免疫調控區,具有了“超感染”能力。在生物膜形成過程中,重編輯的噬菌體能夠取代一部分宿主菌中的溫和噬菌體,成為不斷產生超感染噬菌體的“超級宿主菌”。“超級宿主菌”不僅能大量產生超感染性噬菌體,還表現出對超感染性噬菌體的抵抗能力,進而維持生物膜的結構穩定性,以及生物膜中噬菌體與宿主菌比例的平衡(圖1)。研究結果證實,添加逆轉錄酶抑制劑能夠有效地抑制生物膜中超感染噬菌體的產生。研究的不足之處在于本項研究中還未能直接構建“重編輯噬菌體基因組” 體外反應體系,研究團隊還在繼續相關的嘗試。
逆轉錄酶對DNA病毒基因組編輯功能的這一發現,拓展了人們對噬菌體生物學特征及生物膜中噬菌體與宿主菌復雜互作的微觀認識。近年來,融合CRISPR/Cas9 切口酶的工程化逆轉錄酶以及反轉錄子中的逆轉錄酶展現出作為真核生物基因組編輯工具的巨大潛力,為治療遺傳性疾病和開發定制化治療方案提供了新的可能性。絲狀噬菌體的逆轉錄酶的應用前景也值得探究。
本研究工作得到國家自然科學基金、國家科技部資源調查專項、廣東省本土創新團隊等項目和南海海洋所基礎前沿與創新發展 “一體化”項目的資助。
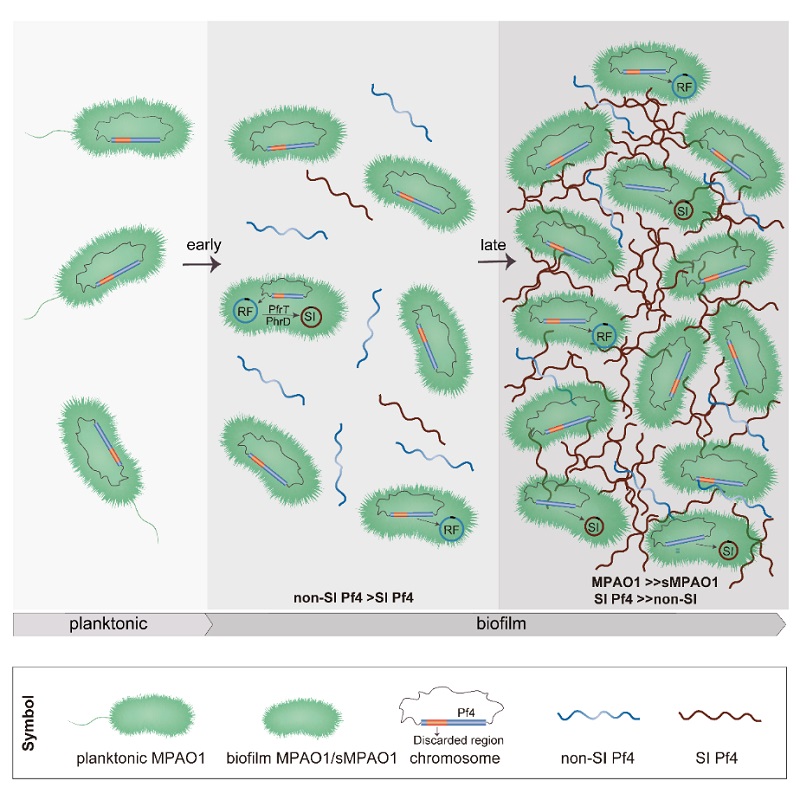
圖1. 逆轉錄酶控制超感染噬菌體Pf4的產生及其在生物膜中擴散模式圖。RF Pf4:復制型Pf4; SI Pf4:超感染Pf4。
相關論文信息:Guo Yunxue #,Lin Shituan#,Chen Ran,Gu Jiayu,Tang Kaihao,Nie Zhaolong,Huang Zixian,Weng Juehua,Lin Jianzhong,Liu Tianlang,Matthew K. Waldor,Wang Xiaoxue*. A reverse transcriptase controls prophage genome reduction to promote phage dissemination in Pseudomonas aeruginosa biofilms. 2024,Cell Reports,43(11):114883.
論文鏈接:doi.org/10.1016/j.celrep.2024.114883
附件下載:


