以CAR-T、CAR-NK為代表的免疫細胞療法被認為是最有可能戰勝腫瘤的新技術,但目前的發展遠達不到預期。多數在研的CAR-T和CAR-NK細胞療法都普遍存在“應對腫瘤抗原異質性不力”、“體內活性不足”和“難以適應抑制性腫瘤微環境(TME)”等缺陷,導致患者難以從中獲益。近期,中國科學院深圳先進技術研究院(簡稱“深圳先進院”)萬曉春團隊在Experimental Hematology & Oncology和Journal for ImmunoTherapy of Cancer期刊上連續發表三項研究成果,為解決限制腫瘤免疫治療效果的核心問題提出了新的解決方案。深圳先進技術研究院先進院博士生張鵬超、牛祥云和Muhammad Auwal Saliu分別為論文第一作者,萬曉春研究員、章桂忠和劉茂玄副研究員為這些工作的通訊作者。
團隊通過創新性整合CAR-T與雙特異性T細胞銜接子(BiTEs),構建出具有雙重靶向能力的BiTEs CAR-T細胞。該設計采用納米抗體和天然受體作為抗原結合域,具有免疫原性低和表達穩定等優勢,顯著提升CAR-T細胞對抗腫瘤抗原異質性的能力,在動物實驗中展現出更強的抗腫瘤效果和良好的安全性(圖1)。該研究在抗原識別維度突破了傳統單靶點限制,為解決腫瘤抗原異質性、腫瘤抗原逃逸問題提供了潛力策略。
在CAR-NK細胞活性調控方面,團隊深入解析了CD28與4-1BB共刺激域在NK細胞中的功能差異及其分子機制,通過系統性比較CAR信號下游分子網絡,成功鑒定出關鍵調控分子MAP3K8。體內外實驗證實,靶向干預MAP3K8可顯著增強CAR-NK細胞的抗腫瘤功能(圖2)。該研究不僅為優化CAR-NK療法提供了新靶點,也為共刺激域的選擇提供了理論依據。
針對實體瘤治療的"最后壁壘"——抑制性TME,團隊開發了活性響應型CAR(Fla)-T細胞:當CAR激活時,可誘導TLR5配體flagellin的表達,實現TME的動態重塑。這種"治療-改造"協同策略不僅增強CAR-T功能,從而更好地清除抗原陽性腫瘤細胞;還能有效激活內源性抗腫瘤免疫,增強機體對抗原異質性腫瘤細胞的殺傷。因此,CAR(Fla)-T細胞在體內實驗中表現出比傳統CAR-T細胞更強的抗腫瘤效果(圖3)。該研究實現了從對TME的被動耐受向主動改造的模式轉變,為靶向TME增強CAR-T療效提供新的思路和潛在的技術方案。
這些研究分別從靶向識別、活性調控、微環境干預三個維度構建了新的解決方案,對實體瘤免疫細胞療法的發展具有積極的意義。研究工作得到了國家重點研發計劃、國家自然科學基金、廣東省基礎與應用基礎研究、深圳市醫學研究專項基金、深圳市科技創新委員會等項目經費的資助。


論文上線截圖
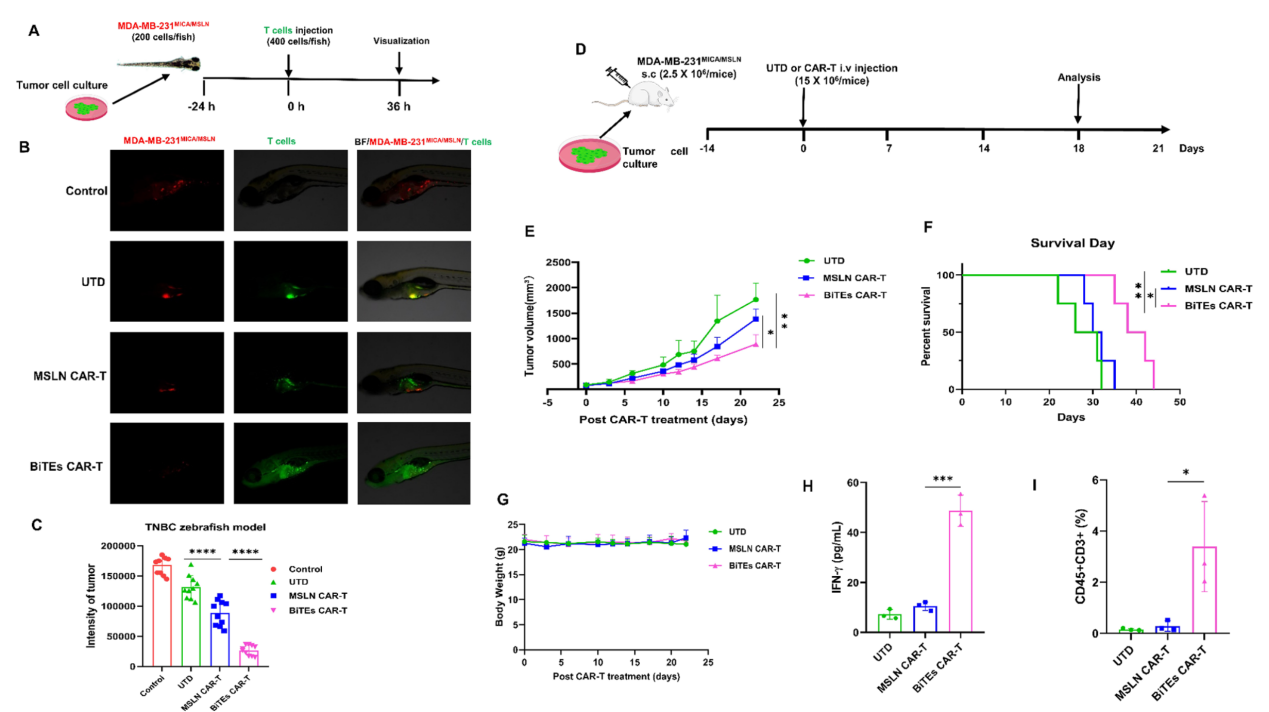
圖1. BiTEs CAR-T cells?在斑馬魚和小鼠移植瘤模型中展現出更強的抗腫瘤效果
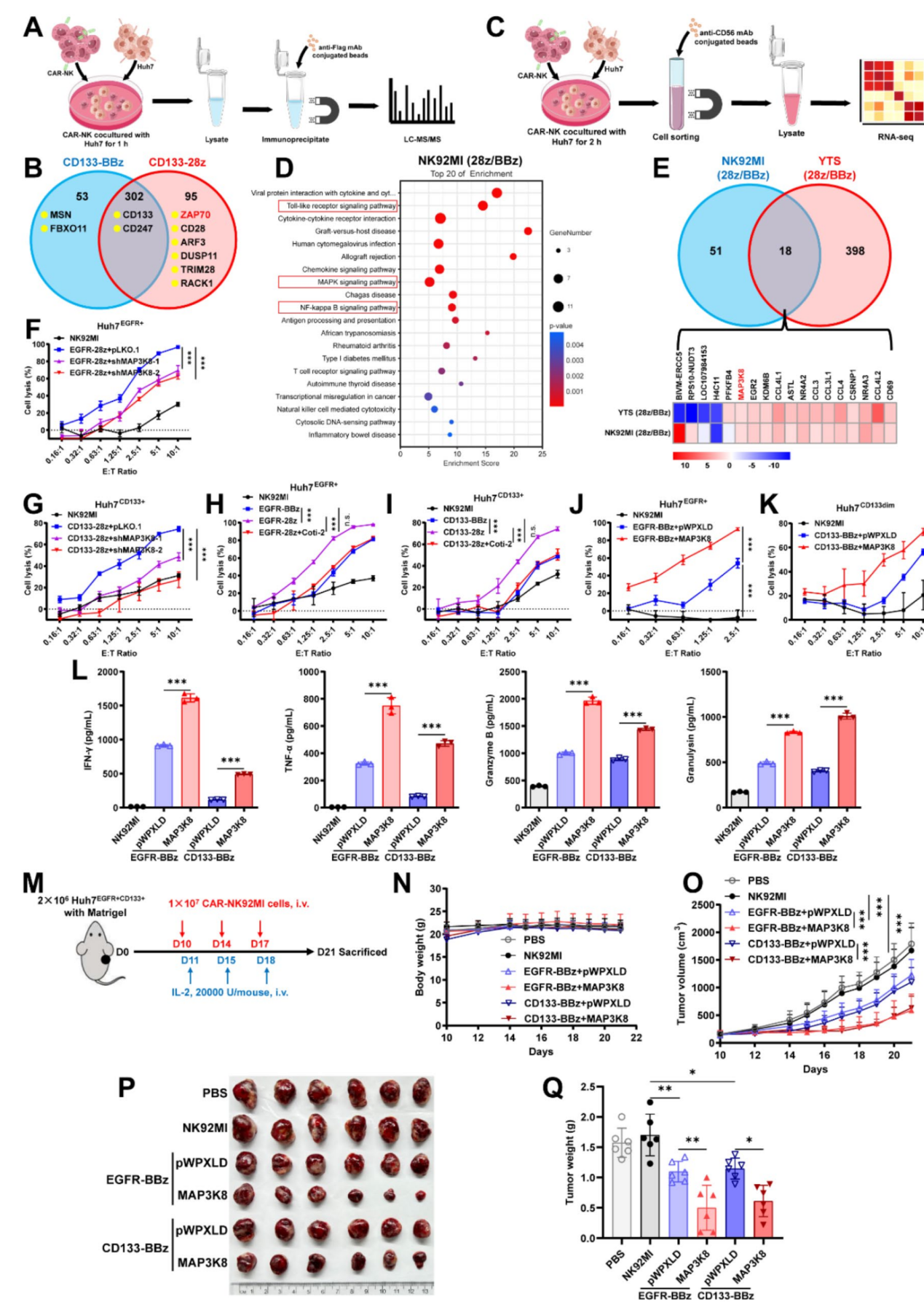
圖2. 28z CAR-NK優于BBz CAR-NK細胞的轉錄組學機制研究與驗證
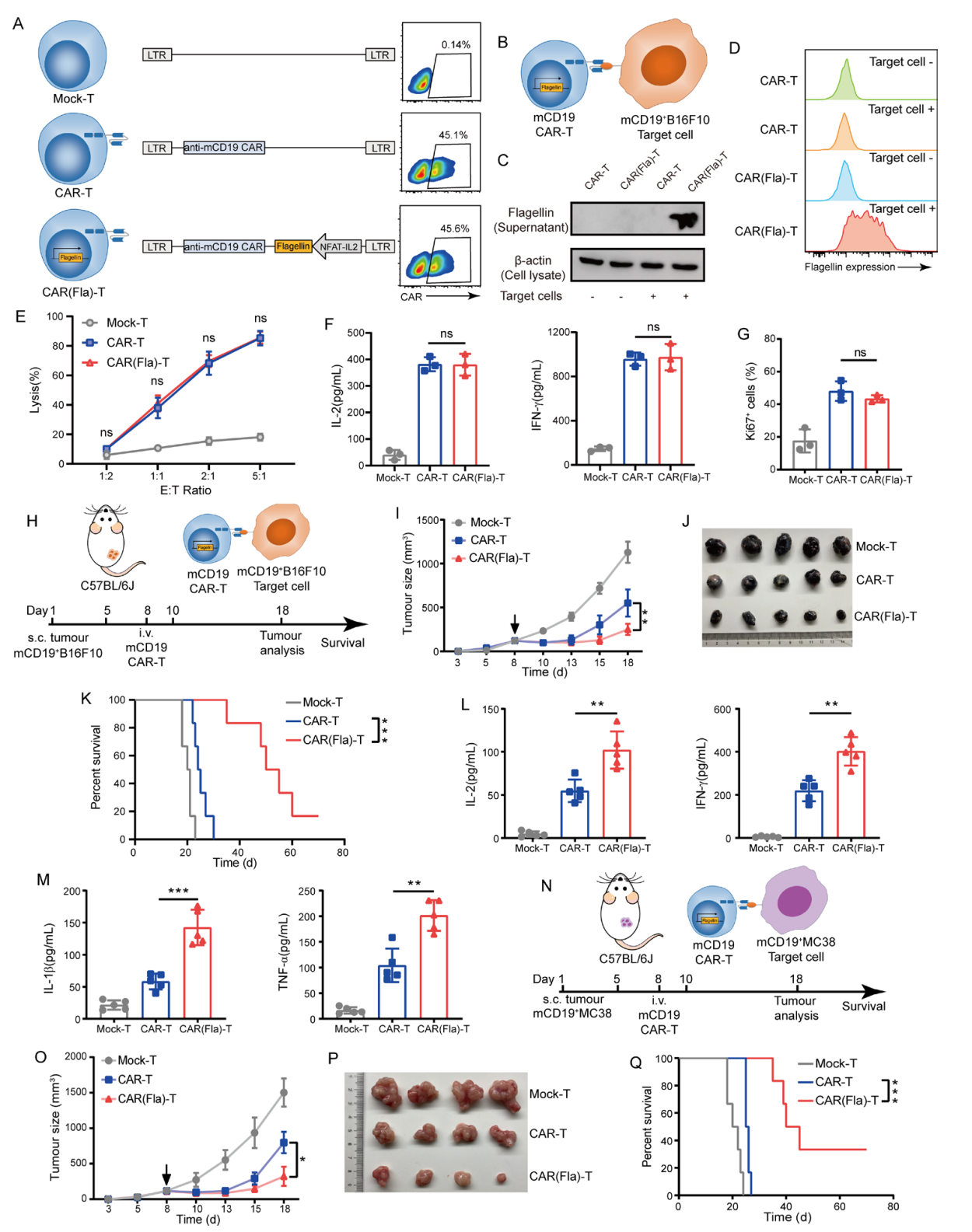
圖3. CAR(Fla)-T細胞具有比傳統CAR-T細胞更好的體內抗腫瘤活性
附件下載:


