4月9日,中國科學院廣州生物醫藥與健康研究院劉興國團隊與廣州醫科大學應仲富團隊在Nature Metabolism期刊上發表了一篇題為The mitochondrial unfolded protein response inhibits pluripotency acquisition and mesenchymal-to-epithelial transition in somatic cell reprogramming的文章。揭示了線粒體未折疊蛋白反應(Mitochondrial unfolded protein response,UPRmt)在多能干細胞命運中通過c-Jun調控組蛋白乙酰化,進而影響間充質-上皮轉化(MET)的新模式(mitochondrial UPR-modulated MET,mtMET)。這一模式的英文縮寫MET是“遇見”的過去式,因此將這一新模式稱為“線粒體遇見”。該研究進一步擴展了線粒體反向調控細胞核并調控細胞命運的研究領域。此外,團隊證明 UPRmt通過增強上皮-間充質轉化 (EMT)促進腫瘤遷移和侵襲,揭示了腫瘤治療的潛在新靶點。
UPRmt是一條重要的線粒體到核的反向調控途徑,線粒體蛋白穩態失衡、活性氧(ROS)升高、線粒體和核基因表達不平衡或者線粒體功能障礙都會激活UPRmt,其激活可以啟動由細胞核編碼的線粒體熱休克蛋白和蛋白酶等基因群轉錄活化程序,促進線粒體功能在應激反應中的維持。在線蟲中UPRmt會延長壽命,然而在哺乳動物細胞中UPRmt在干細胞命運決定和發育中的作用,在很大程度上仍未得到探索。
團隊首先全面的檢測多能性的不同狀態:獲得、退出,以及二細胞期-著床前-著床后的狀態轉換中UPRmt的變化規律。結果表明,多能性獲得、退出時,?UPRmt具有顯著的變化。其中,UPRmt在多能性獲得早期階段短暫激活,隨后逐漸減弱。同時發現c-Myc是UPRmt激活的關鍵因子。c-Myc的過表達能夠顯著增加UPRmt的標志物Hsp60的表達,而其他轉錄因子(Sox2、Klf4和Oct4)則沒有類似效果。進一步的研究發現,在多能性的獲得中UPRmt的激活抑制了MET過程。團隊同時也檢測了哺乳動物早期分化和腫瘤中,UPRmt同樣發揮了調控MET的作用。UPRmt的激活可以增強癌細胞的遷移和侵襲能力。
在機制方面,團隊通過篩選獲得UPRmt反向調控通路中的全新關鍵因子c-Jun。c-Jun是一個原癌基因,會抑制多能性的獲得,而UPRmt的激活會促進c-Jun的表達。c-Jun通過轉錄調控,上調乙酰輔酶A代謝酶的表達,從而降低乙酰輔酶A的水平。由于乙酰輔酶A與組蛋白乙酰化密切相關,研究團隊進一步發現UPRmt的激活會減少組蛋白的乙酰化,特別是H3K9乙酰化(H3K9Ac)的水平。團隊繼續發現UPRmt的激活會減少H3K9Ac與上皮樣相關基因(E-cadherin和Epcam等基因)啟動子區域的結合,這種H3K9Ac水平的降低使得H3K9Ac與上皮樣相關基因的結合減少并抑制上皮樣相關基因的表達,抑制MET。通過補充乙酰輔酶A的前體物質(如乙酸、檸檬酸和丙酮酸),可以恢復H3K9Ac的水平,并恢復MET相關基因的表達水平。
綜上,這項研究首次揭示了在多能干細胞命運調控中UPRmt通過c-Jun降低乙酰輔酶A水平,減少組蛋白乙酰化,進而抑制MET的新通路。這種線粒體調控MET的模式也存在于早期分化和腫瘤領域,是具有廣泛性的生物作用模式。
“千錘百煉志如鋼,萬難不移意未央”,當線粒體面臨“壓力山大”時,她會悄悄告訴細胞核,細胞核會發出指令改變細胞的“顏值”:能屈能伸的細胞從彼此之間緊密附著的上皮細胞“靜若處子”,變為表現出更多的遷移和侵襲能力的間充質細胞“動若脫兔”。而這一細胞變身,聯系了UPRmt、干細胞這兩大長壽因素,正是“管卻細胞變身事,自信人生雙甲長”。
本研究是中國科學院廣州生物醫藥與健康研究院、廣州醫科大學、中國科學院香港創新研究院再生醫學與健康創新中心、香港中文大學、山東農業大學、香港大學、西湖大學等多個研究組合作完成。本研究獲國家重點研發項目、中國科學院、國家自然科學基金、廣東省和廣州市的經費支持。
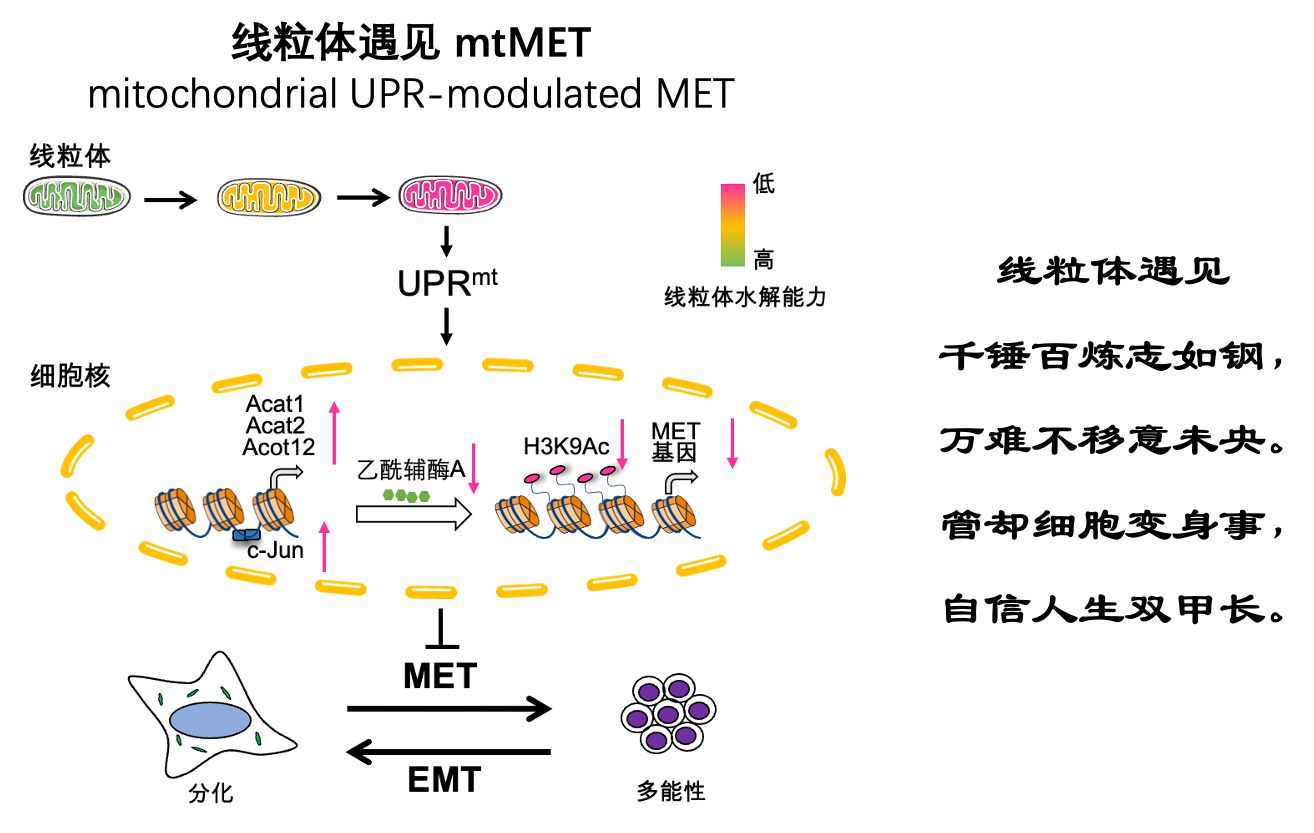
圖1?線粒體未折疊蛋白反應通過調控間充質-上皮轉化阻礙細胞多能性獲得
附件下載:


